Dermatol Rev Mex. 2024; 68 (5): 729-731. https://doi.org/10.24245/drm/bmu.v68i5.10063
Ramón Jacobo Parada,1 Jazmín Tejeda Olán,2 Javier Araiza Santibáñez,2 Areli Martínez Gamboa,3 Alexandro Bonifaz2
1 Dermatólogo, práctica privada.
2 Laboratorio de Micología, Servicio de Dermatología, Hospital General de México Dr. Eduardo Liceaga, Ciudad de México.
3 Departamento de Enfermedades Infecciosas, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, Ciudad de México.
Estimado editor:
Las infecciones cutáneas por Chrysosporium en humanos son poco frecuentes y en la mayoría de los casos subdiagnosticadas. El género anamorfo Chrysosporium incluye especies queratinofílicas, son saprofitos comúnmente aislados de restos de pelo y plumas en el suelo, material vegetal y estiércol.1
Estos hongos rara vez se reportan como patógenos animales (excepto en reptiles) y en humanos se consideran emergentes, relativamente cercanos filogenéticamente a los dermatofitos. Los reportes de las especies implicadas en micosis humanas son Chrysosporium keratinophilum y Chrysosporium pannicola en infecciones de la piel y uñas, así como algunas infecciones profundas por Chrysosporium zonatum.2 Sin embargo, en los últimos años ha habido un aumento notable de micosis causadas por algunos hongos relacionados con este género en reptiles y en humanos, sobre todo en pacientes inmunosuprimidos y, por lo regular, causan cuadros clínicos más inflamatorios, por el poco reconocimiento antigénico.
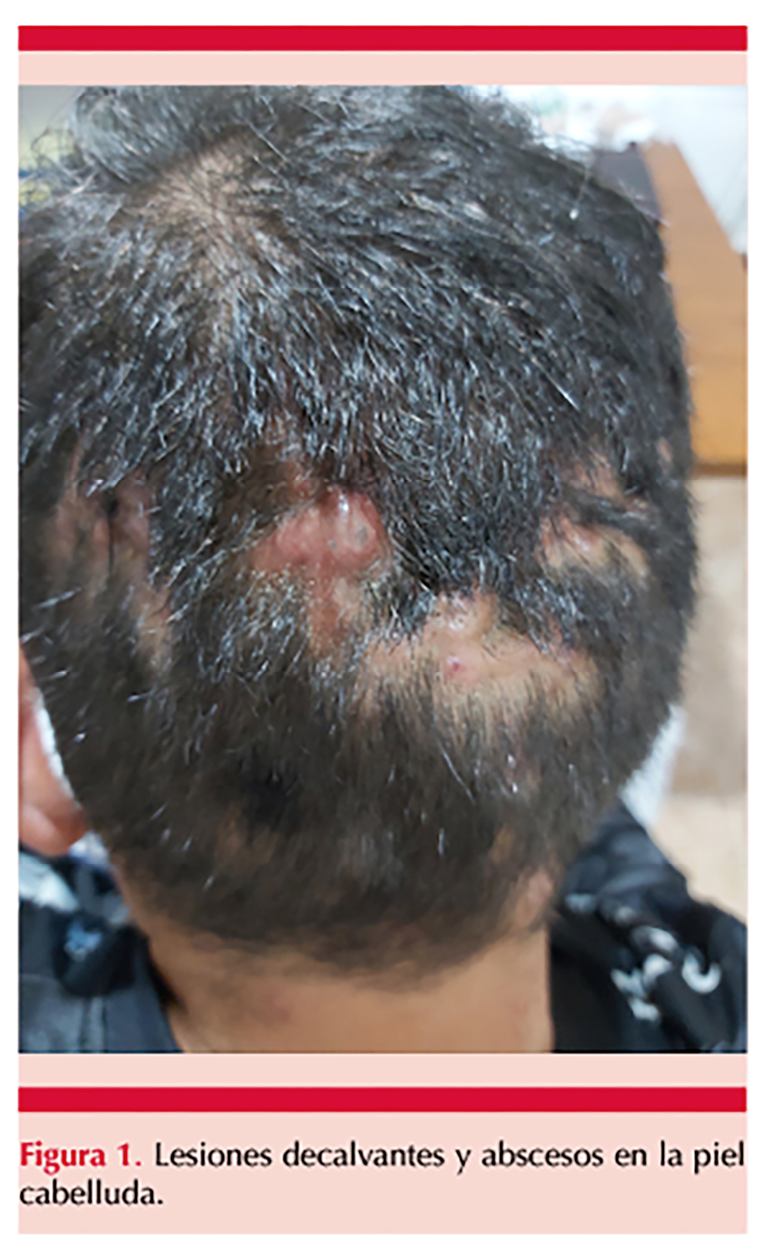
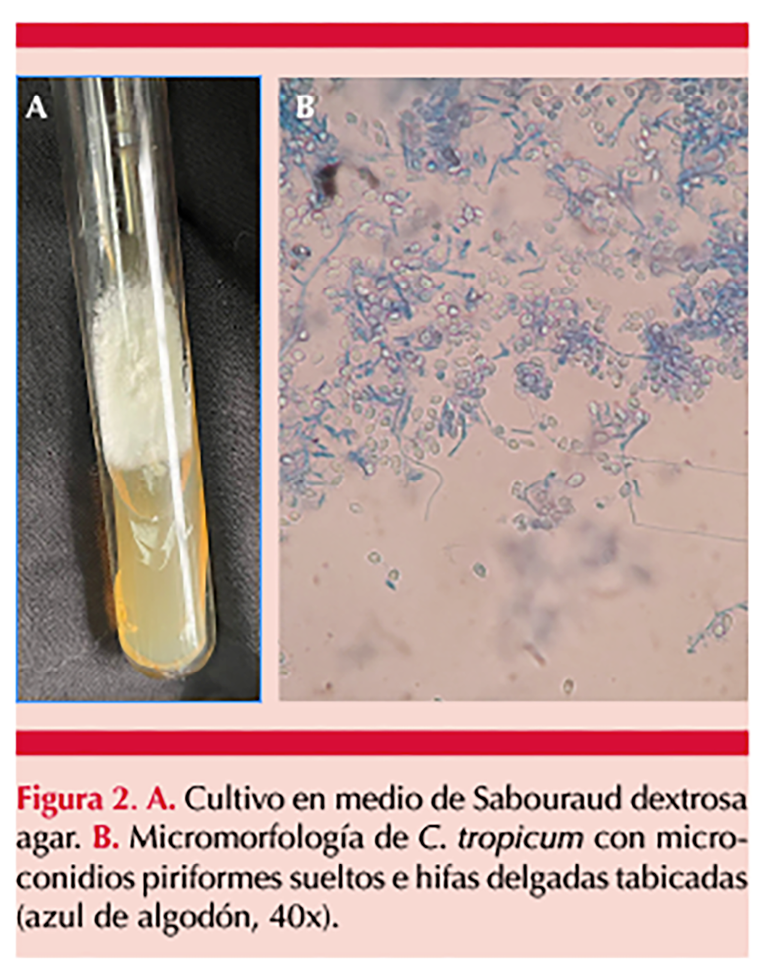
Se comunica el caso de un paciente de 25 años, originario y residente del Estado de México, sin antecedentes patológicos relevantes para el padecimiento actual, que acudió a consulta por padecer una dermatosis localizada a la piel cabelluda en el área superior occipital, parietal con extensión hacia áreas temporales, constituida por abscesos fluctuantes, costras melicéricas, zonas decalvadas inflamadas, dolor a la palpación y algunas cicatrices de aspecto queloide, con evolución de 4 meses y tratamiento previo con clindamicina sistémica sin remisión de las lesiones (Figura 1), por lo que se le solicitó análisis micológico, en el que se hizo examen directo del material purulento y tinción de Gram. A la microscopia de la tinción se encontraron abundantes estructuras cocoides grampositivas; otra parte del material biológico se cultivó por triplicado en medio de Sabouraud dextrosa agar con y sin antibiótico y se obtuvo desarrollo a los 14 días de incubación a 25 °C, colonias planas, blancas, pulverulentas sin pigmento difusible. En el análisis microscópico del hongo se observaron hifas delgadas septadas hialinas con abundantes conidios piriformes sueltos grandes de aproximadamente 10 µm que permitieron identificarlo como Chrysosporium sp. La confirmación de la especie se hizo por MALDI-TOF MS®; de acuerdo con las librerías disponibles éstas fueron Chrysosporium shanxiense por MALDI BRUKER® y Chrysosporium tropicum por MSI, con lo que se concluyó la identificación mediante secuenciación genética como C. tropicum. Figura 2
Se estableció el diagnóstico final de dermatomicosis inflamatoria de la piel cabelluda por el agente mencionado; se inició tratamiento antimicótico con itraconazol a dosis de 200 mg al día complementado con corticosteroides tópicos. El paciente mostró respuesta satisfactoria al tratamiento, no acudió a la última visita de seguimiento, se consideró curado clínica y micológicamente.
El caso comunicado correspondería a una foliculitis decalvante apoyado con lo observado en la tinción de Gram; sin embargo, al no haber alivio de las lesiones con el esquema terapéutico de elección y el crecimiento del hongo en los cultivos, se plantearía que el agente aislado tiene implicación patológica en el padecimiento porque no se considera contaminación al aislarlo por triplicado, lo que confirma su causa. En retrospectiva, las estructuras cocoides observadas en la tinción de Gram pudieran corresponder a pequeños microconidios, aun así, las estructuras parasitarias esperadas serían también hifas y artroconidios.
En la bibliografía sólo se ha informado a C. tropicum en un caso de sinusitis fúngica invasora en un paciente con inmunodeficiencia adquirida,3 pero sin afectar la piel; en tanto que, en los casos cutáneos, se han descrito diferentes tipos de lesiones: placas eritemato-escamosas, abscesos y placas verrugosas.4
Hay estudios que demuestran la diversidad genética entre especies de Chrysosporium. Las asociadas con los humanos son distintas de las de los reptiles, lo que mitiga las preocupaciones relacionadas con la zoonosis, por lo que la manipulación de mascotas exóticas no supone más riesgo para una persona inmunosuprimida que el contacto con otras personas o el medio ambiente. Sin embargo, en estos casos deben tomar precauciones, como la implementación de medidas de protección personal debido a que los animales exóticos o salvajes pueden albergar patógenos poco comunes.5
También se ha descrito la termotolerancia en C. tropicum, es decir, es capaz de crecer en un amplio intervalo de temperatura, se comporta como mesófilo creciendo a temperaturas óptimas de 10 a 35 °C y máximas que van de 48 a 50 °C o extremas mayores a 50; estas altas temperaturas de crecimiento pueden ser importantes para determinar el hábitat en el que se encuentra este tipo de hongos, por ejemplo, climas cálidos, secos y templados. La capacidad de desarrollarse en un amplio intervalo de condiciones ambientales le permite adaptarse a grandes fluctuaciones de temperatura, como lo es ahora el clima global, regional y local.6
En conclusión, el caso clínico comunicado es el primero en México y excepcional por sus manifestaciones y evolución clínica. Las lesiones persistentes o recurrentes, como casos de foliculitis decalvante, incluso después del tratamiento antibiótico, necesitan una valoración adicional y diagnósticos diferenciales que incluyen los micológicos aun en pacientes inmunocompetentes. El polimorfismo lesional de las dermatomicosis junto con el aumento de la diversidad de los hongos emergentes son desafíos para el diagnóstico por laboratorio. También debe considerarse el efecto del cambio climático en las enfermedades fúngicas creando redes de vigilancia para el establecimiento de datos epidemiológicos.
REFERENCIAS
1. Dincy PC, Meera T, Susanne PA, Promila RM. Disseminated cutaneous Chrysosporium infection. Trop Doct 2019; 49 (4): 306-308. doi: 10.1177/0049475519845779
2. Cabañes FJ, Sutton DA, Guarro J. Chrysosporium-related fungi and reptiles: A fatal attraction. PLoS Pathog 2014; 10 (10): e1004367. doi:10.1371/ journal.ppat.1004367
3. Guerrero Palma MA, Ávila Espín L, Fernández Pérez A, Moreno León JA. Micosis nasosinusal invasiva por Chrysosporium tropicum [Invasive sinusal mycosis due to Chrysosporium tropicum]. Acta Otorrinolaringol Esp 2007; 58 (4): 164-6.
4. Mijiti J, Pan B, de Hoog S, Deng S et al. Severe chromoblastomycosis-like cutaneous infection caused by Chrysosporium keratinophilum. Front Microbiol 2017; 8: 83. doi: 10.3389/fmicb.2017.00083
5. Sigler L, Hambleton S, Paré JA. Molecular characterization of reptile pathogens currently known as members of the Chrysosporium anamorph of Nannizziopsis vriesii complex and relationship with some human-associated isolates. J Clin Microbiol 2013; 51 (10): 3338-57. doi: 10.1128/JCM.01465-13
6. Frías-De-León MG, Brunner-Mendoza C, Reyes-Montes MR, Duarte-Escalante E. The Impact of climate change on fungal diseases. Berlin: Springer, 2022; 37-50. doi.org/10.1007/978-3-030-89664-5
Recibido: marzo 2024
Aceptado: marzo 2024
Este artículo debe citarse como: Jacobo-Parada R, Tejeda-Olán J, Araiza-Santibáñez J, Martínez-Gamboa A, Bonifaz A. Dermatomicosis en la piel cabelluda causada por Chrysosporium tropicum. Una infección excepcional. Dermatol Rev Mex 2024; 68 (5): 729-731.