Superficial cutaneous trichosporonosis: An uncommon disease that should not be overlooked in hospitalized patients.
Dermatol Rev Mex. 2026; 70 (1): 137-140. https://doi.org/10.24245/dermatolrevmex.v70i1.10964
Gloria Fernández Robles,1 Myrna Mariela Elizondo Elizondo,1 Cristian Camilo Infante García,2 Joaquín Moreno Moreno,2 Jazmín Tejeda Olán,1 Javier Araiza Santibáñez,1 Alexandro Bonifaz1
1 Servicio de Dermatología-Micología
2 Servicio de Infectología
Hospital General de México Dr. Eduardo Liceaga, Ciudad de México.
Estimados editores:
Trichosporon spp, hongos levaduriformes, están ampliamente distribuidos en la naturaleza; se encuentran predominantemente en regiones tropicales y templadas.1 Pueden formar parte del microbiota normal de la piel, la vagina y el tubo gastrointestinal de diversos animales, como aves y humanos.2 En un estado de desequilibrio de éste, los pacientes inmunodeprimidos y los no inmunodeprimidos son susceptibles a la tricosporonosis que puede manifestarse como infecciones superficiales o profundas, como la fungemia.3 Se han documentado casos en Asia, Europa, América y África; Asia suma la mayor proporción (77%) de los casos reportados; los países con más reportes incluyen China, Japón e India, que representan el 65.7% del total.4 La especie Trichosporon asahii causa la mayor parte de las tricosporonosis y es causante de los casos viscerales y diseminados.5 En la actualidad el género Trichosporon incluye cuatro ramas evolutivas y cerca de 50 especies, muchas de las cuales pueden ser patógenas para los humanos: Trichosporon asahii, Trichosporon cutaneum (que causa tricosporonosis cutánea), Trichosporon inkin, Trichosporon asteroides y Trichosporon japonicum. Entre las especies de Trichosporon, T. asahii es la más patógena y letal.6 El diagnóstico definitivo requiere el aislamiento de Trichosporon spp de sitios estériles como cultivos de sangre o tejidos, a menudo respaldado por microscopia directa y examen histopatológico. La identificación temprana y el inicio rápido del tratamiento antimicótico son fundamentales.1
Se comunica el caso de una paciente sin antecedente de padecimientos crónico-degenerativos, de 44 años, originaria y residente de Tuxtla Gutiérrez, Chiapas, de ocupación hogar, hospitalizada por fuga de anastomosis secundaria a restitución de tránsito intestinal colorrectal-anastomosis término-terminal. Tuvo múltiples intervenciones quirúrgicas por una evolución tórpida y progresó a abdomen hostil BJORK 3B y peritonitis generalizada secundaria a perforación intestinal. En su día 32 de estancia hospitalaria manifestó una dermatosis localizada que afectaba el tronco posterior y los glúteos, constituida por placas eritematosas, de diferentes tamaños, algunas confluían formando lesiones de mayor tamaño, con escama fina blanquecina, bien adherida y áreas de maceración, acompañada de prurito intenso. Figura 1
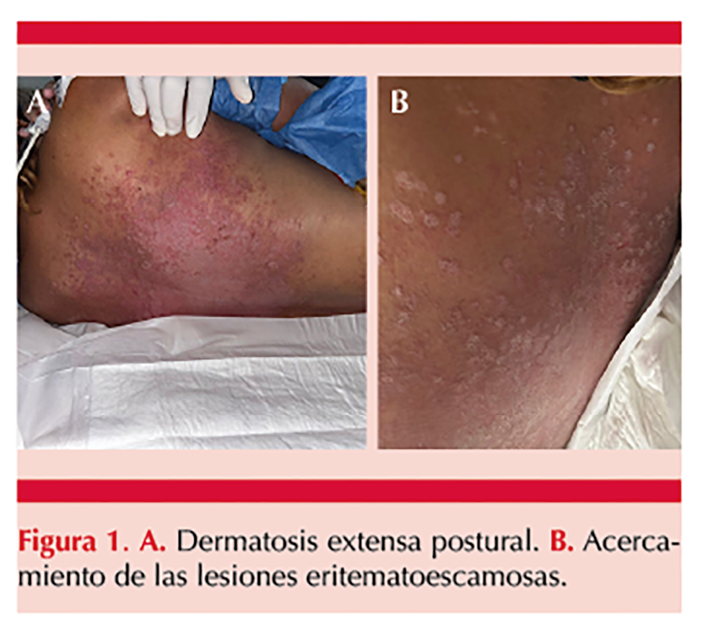
Por los antecedentes de inmovilización y exposición a humedad, con base en el aspecto clínico y por su estancia hospitalaria, se estableció el diagnóstico presuntivo de candidosis cutánea diseminada asociada con la postura hospitalaria. Estudio micológico: al examen directo (KOH 10%) se observaron blastoconidios, pseudohifas e hifas. Se practicó cultivo en los medios de Sabouraud-dextrosa agar, y CHROMagarTM Candida. Con estos hallazgos clínicos y micológicos se consideró el diagnóstico de candidosis cutánea superficial postural, por lo que se inició tratamiento con fluconazol a dosis de 300 mg vía oral semanalmente durante cuatro semanas.
Al desarrollo del cultivo se identificaron colonias blancas de aspecto rugoso de color azul turquesa (en CHROMagarTM Candida). A la microscopia se observaron hifas acompañadas de blastoconidios y artroconidios (Figura 2), por lo que se identificó como Trichosporon sp.
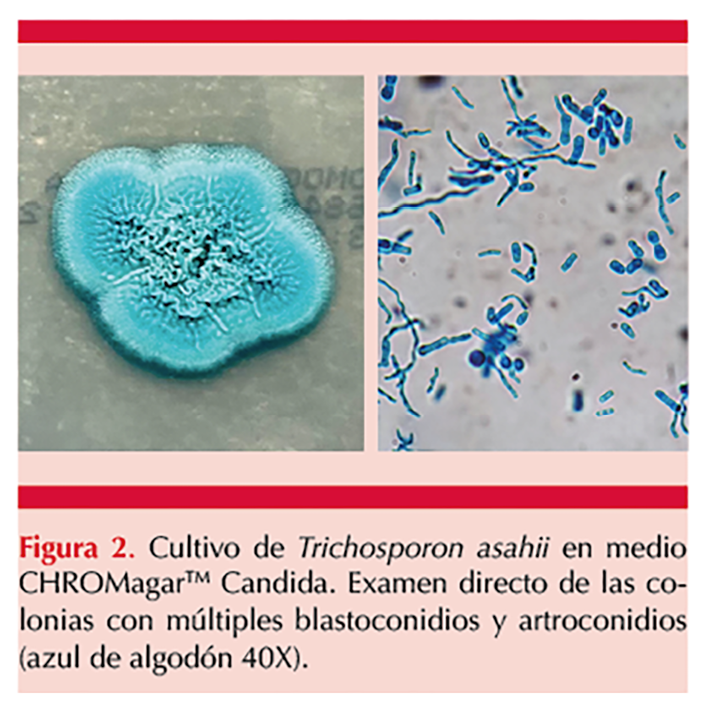
El cultivo se sometió a MALDI-TOF (VITEK® MS), con lo que se identificó Trichosporon asahii. Con base en lo anterior se estableció el diagnóstico de tricosporonosis cutánea superficial causada por T. asahii. El tratamiento se inició 14 días después a la aparición de la dermatosis con fluconazol a dosis de 200 mg vía intravenosa cada 24 horas durante cinco días, indicado por el infectólogo, quien, además, indicó cambio y retiro de catéter y toma de hemocultivos ante picos febriles.
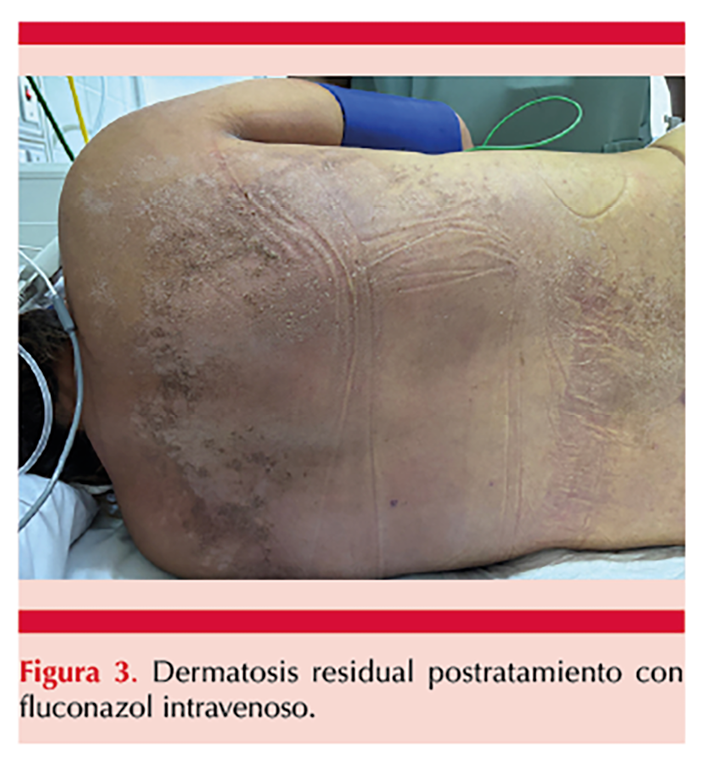
La radiografía de tórax reveló infiltrados bilaterales, difusos; además, la paciente manifestó aumento de respuesta leucocitaria y datos de síndrome de respuesta inflamatoria sistémica. Posteriormente, ante los datos de insuficiencia respiratoria aguda secundaria a neumonía intrahospitalaria, la paciente requirió manejo avanzado de la vía aérea. Después del tratamiento con fluconazol la paciente mostró mejoría clínica y los cultivos micológicos resultaron negativos. Figura 3
La infección cutánea superficial por T. asahii representa un hallazgo clínico inusual porque este agente micótico se asocia con mayor frecuencia con infecciones sistémicas graves en pacientes inmunodeprimidos, particularmente en el contexto de neutropenia prolongada, trasplante de órganos o tratamientos con agentes inmunosupresores. En contraste, las infecciones superficiales del género Trichosporon, como la piedra blanca y algunas formas de foliculitis o intertrigo, suelen asociarse con especies diferentes: T. ovoides, T. inkin o T. cutaneum. Estas especies tienen mayor afinidad por estructuras queratinizadas como el pelo o la piel húmeda, especialmente en regiones intertriginosas, y se consideran parte del microbiota cutáneo en ciertos contextos.1,2,3
La infección superficial por T. asahii es extremadamente infrecuente, con pocos casos reportados en la bibliografía. Su identificación como agente etiológico en una forma cutánea localizada, sin daño sistémico aparente, sugiere una vía de colonización o infección distinta a la habitual y plantea la posibilidad de que su presencia en la piel sea subestimada o erróneamente atribuida a otras levaduras.3 A pesar de que la infección se manifiesta de forma superficial y, en particular, cuando es ocasionada por T. asahii, éste puede ser el foco primario de una infección sistémica, de aquí la importancia del diagnóstico preciso.3
Uno de los desafíos clínicos y diagnósticos radica en la identificación precisa de la especie. La identificación correcta mediante pruebas micológicas convencionales y, en gran parte de los casos, mediante métodos moleculares o espectrometría de masas (MALDI-TOF), es decisiva para distinguir T. asahii de otras especies del mismo género. Su identificación debe alertar al clínico de la posibilidad de una diseminación en pacientes con factores de riesgo. Desde el punto de vista terapéutico, T. asahii tiene una susceptibilidad variable a los antifúngicos, con una conocida resistencia relativa a la anfotericina B y mejor respuesta a triazoles, como voriconazol o posaconazol.3,6
La rareza del caso radica en varios factores: la predilección de T. asahii por infecciones sistémicas porque tiene un marcado tropismo por tejidos profundos y se considera un patógeno oportunista emergente. La manifestación como una infección limitada a la piel, sin evidencia de diseminación sistémica, es extremadamente infrecuente. Hasta la fecha, los casos documentados de tricosporonosis cutánea superficial por T. asahii son escasos y, en ocasiones, anecdóticos, por lo que resalta la importancia de considerar a T. asahii posible agente de infecciones superficiales cutáneas, especialmente en contextos en los que no se identifica una causa clara o cuando existe falla terapéutica con tratamientos antimicóticos convencionales. La documentación de estos casos es fundamental para ampliar el conocimiento de la variabilidad clínica de este hongo emergente y para alentar de su potencial comportamiento patógeno, incluso fuera del contexto de un paciente con inmunodepresión.
REFERENCIAS
1. Padovan ACB, Rocha WPDS, Toti ACM, et al. Exploring the resistance mechanisms in Trichosporon asahii: Triazoles as the last defense for invasive trichosporonosis. Fungal Genet Biol 2019; 133: 103267. https://doi.org/10.1016/j.fgb.2019.103267
2. Miranda IL, Peres NTA, Bastos RW, et al. Trichosporon and antifungal resistance: Current knowledge and gaps. Mycopathologia 2025; 190 (4): 59. https://doi.org/10.1007/s11046-025-00969-z
3. Colombo AL, Padovan ACB, Chaves GM. Current knowledge of trichosporon spp. and trichosporonosis. Clin Microbiol Rev 2011; 24 (4): 682-700. https://doi.org/10.1128/cmr.00003-11
4. Tian S, Li H, Zhao J, Sun Y, Lu Z, Chen S. Clinical features and molecular epidemiology of Trichosporon asahii infections from a 10-year retrospective study. J Clin Microbiol 2020; 58 (3): e01710-19.
5. Commenges A, Coucheney F, Lessard MH, et al. Trichosporon asahii: Taxonomy, health hazards, and biotechnological applications. Fungal Biol 2024; 49: 100369. https://doi.org/10.1016/j.fbr.2024.100369
6. Zhang H, Zhang J. Trichosporon asahii: emerging challenges in pathogenesis and drug resistance. Future Microbiol 2025; 20 (4): 333-343. https://doi.org/10.1080/17460913.2025.2457858
Este artículo debe citarse como: Fernández-Robles G, Elizondo-Elizondo MM, Infante-García CC, Moreno-Moreno J, Tejeda-Olán J, Araiza-Santibáñez J, Bonifaz A. Tricosporonosis cutánea superficial: enfermedad infrecuente que no debe pasar inadvertida en pacientes hospitalizados. Dermatol Rev Mex 2026; 70 (1): 137-140.