HLA in Mexican dermatology.
Dermatol Rev Mex. 2022; 66 (4): 469-476. https://doi.org/10.24245/dermatolrevmex.v66i4.7928
Julio Granados,1 Daniela Ruiz-Gómez,2 José F Llanos-Rodríguez,1 Susana Hernández-Doño1
1 División de inmunogenética, departamento de Trasplantes, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, Ciudad de México.
2 Departamento de Dermatología, Hospital General Dr. Manuel Gea González, Ciudad de México.
ANTECEDENTES
Han transcurrido más de 30 años desde el primer reporte de asociación de un gen de HLA (HLA, human leukocyte antigen) específico con una enfermedad. Desde entonces, más de 500 enfermedades diferentes en las que se incluyen múltiples afecciones dermatológicas, la mayor parte de origen autoinmunitario, se han vinculado con este grupo de genes.1,2
El antígeno leucocitario humano (HLA) se refiere a un grupo de genes que pertenece al complejo principal de histocompatibilidad (MHC), que se divide en tres grupos: la región de clase I, que comprende los genes altamente polimórficos HLA-A, HLA-B, HLA-C; la región de clase II que incluye los genes HLA-DR, HLA-DQ y HLA-DP, y la región de clase III que contiene genes implicados en la respuesta inflamatoria, maduración leucocitaria y el sistema del complemento.3
La susceptibilidad o protección relacionada con estos genes depende de la etnicidad y, en consecuencia, del mestizaje de cada persona, por lo que la combinación de variantes genéticas (alelos) forma bloques (haplotipos) que varían en cada población estudiada. En México, la mezcla entre etnias es muy heterogénea por lo que distintos haplotipos pueden verse implicados de acuerdo con la región del país, lo que da lugar a distintas manifestaciones clínicas de la misma enfermedad.3,4 Cabe señalar que las enfermedades dermatológicas inmunomediadas son multifactoriales, por lo que la existencia de un alelo o haplotipo (conjunto de genes HLA) de susceptibilidad requiere la participación de otros factores además de los genéticos, por ejemplo infecciosos, para que se exprese la fisiopatogenia de las enfermedades. En este sentido, el mimetismo molecular (molecular mimicry) es un mecanismo fisiopatológico de las enfermedades autoinmunitarias. Figura 1
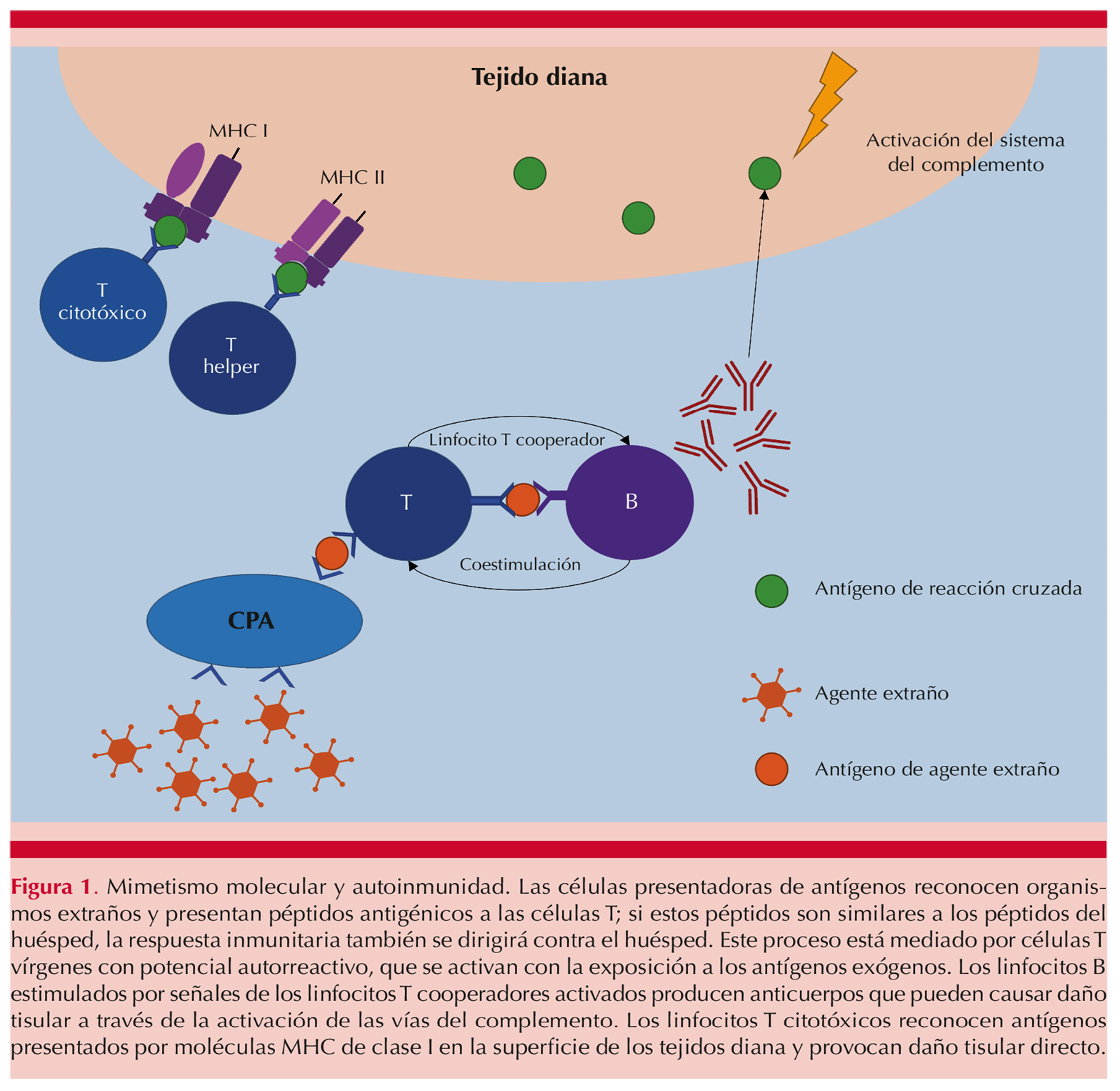
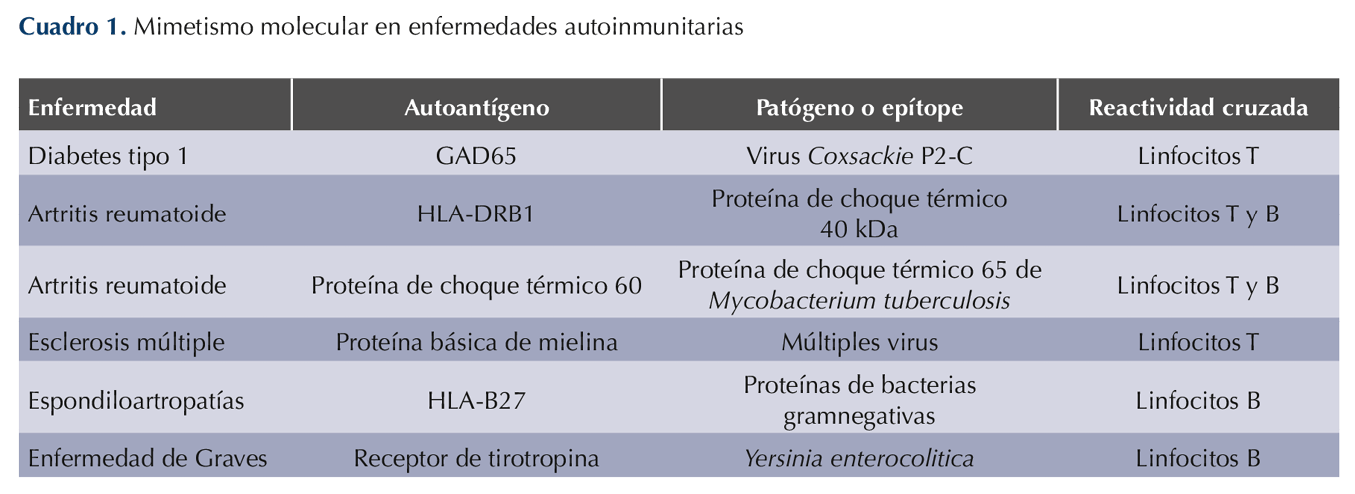
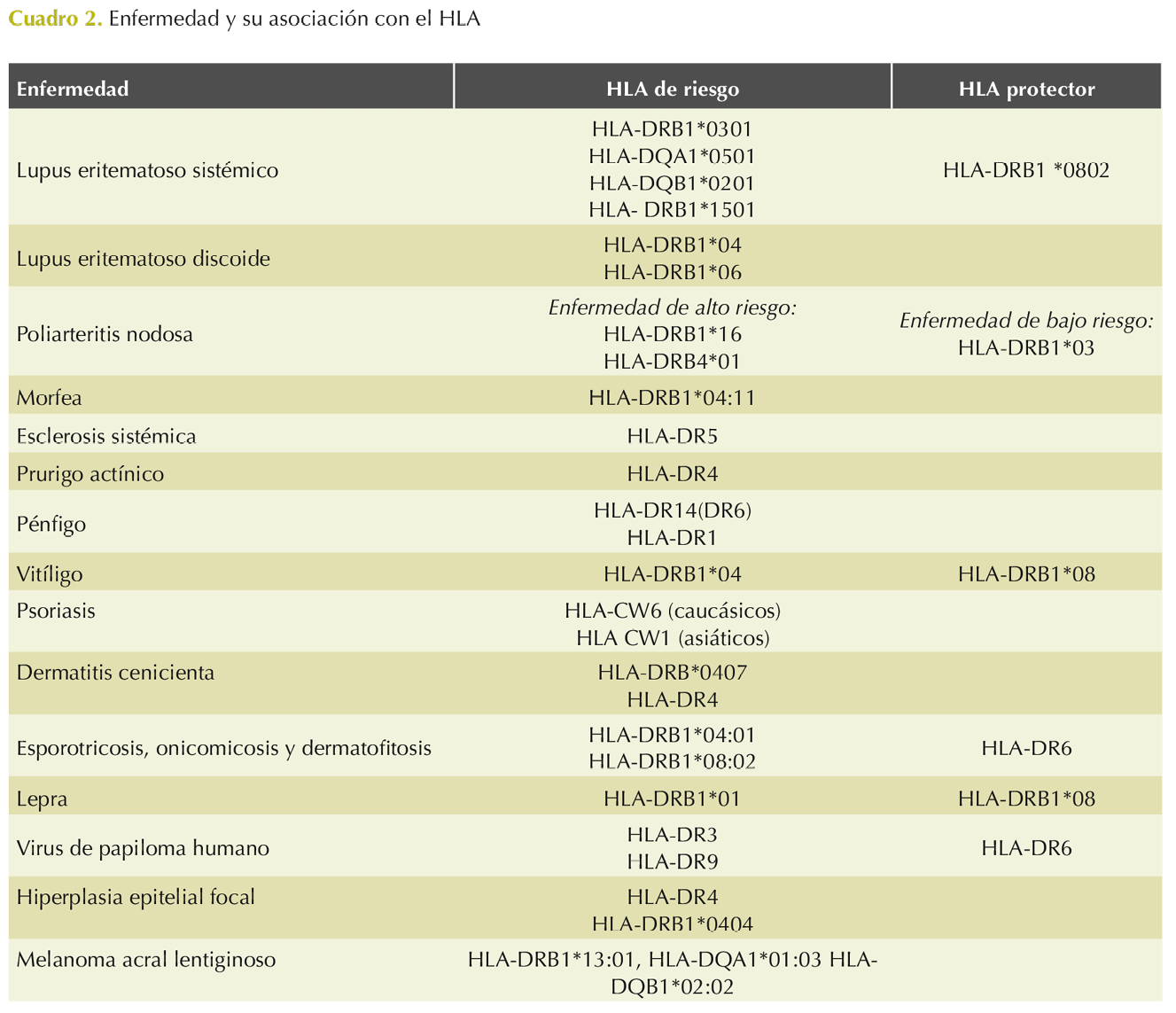
Se han propuesto distintos autoantígenos y su mimetismo con proteínas de patógenos (Cuadro 1). En este trabajo se muestra una breve revisión de las asociaciones del HLA en distintas enfermedades dermatológicas. En el Cuadro 2 se resumen los alelos de susceptibilidad y protección de distintas enfermedades dermatológicas.
HLA EN ENFERMEDADES AUTOINMUNITARIAS
Lupus eritematoso
El lupus eritematoso es una enfermedad autoinmunitaria crónica, caracterizada por la pérdida de tolerancia a antígenos propios. Tiene manifestaciones clínicas diversas que incluyen un espectro de enfermedad aguda, subaguda y crónica. En el lupus eritematoso sistémico (LES) el haplotipo HLA-DRB1*0301-DQA1*0501-DQB1*0201 está asociado con riesgo de lupus eritematoso sistémico, así como el alelo DRB1*1501 y al contrario, el alelo HLA-DRB1 *0802 se asocia como protector.
En el lupus eritematoso discoide crónico en mestizos mexicanos existe una asociación de susceptibilidad con el HLA-DRB1*04 y HLA-DRB1*06. López-Tello y su grupo discuten que la existencia del HLA-DRB1*16 puede estar relacionada con una forma distinta de lupus discoide de los asociados con HLA-DRB1*04. En 2021 Hernández-Doño y colaboradores demostraron que los genes de los pacientes con lupus eritematoso sistémico están más cerca de las poblaciones no autóctonas (suroeste de Europa, África subsahariana y Asia oriental) que los individuos sanos, mientras que los genes de los individuos sanos están más cerca de las poblaciones autóctonas. Lo anterior sugiere que las manifestaciones que distinguen la enfermedad en mestizos mexicanos, como es el caso de la nefritis lúpica, son producto del mestizaje.3,5
Poliarteritis nodosa
La poliarteritis nodosa es una vasculitis necrotizante que afecta a arterias de mediano y pequeño calibre, con daño a diversos órganos. Las lesiones dermatológicas constituyen la manifestación clínica más característica: livedo reticularis, púrpura, nódulos dolorosos y úlceras. Al ser una enfermedad inflamatoria se ha encontrado asociación con HLA-DR. En un estudio en el que se comparó el HLA-DR en pacientes con poliarteritis nodosa con controles sanos no se observaron diferencias significativas entre los grupos estudiados. Sin embargo, diferentes alelos del HLA se asociaron con diversos polimorfismos. Así, la frecuencia del HLA-DRB1*16 y DRB4*01 tuvo que ver con mayor actividad de la enfermedad. Por otro lado, los pacientes con formas menos graves de la enfermedad mostraron mayor frecuencia de HLA-DRB1*03. De manera adicional, los alelos HLA-DRB1*11, HLA-DRB1*12, HLA-DRB1*13 y HLA-B3 afectaron el aparato gastrointestinal. En contraste, los pacientes con enfermedad renal tuvieron una frecuencia incrementada de HLA-DRB1*15 o HLA-DRB1*16 y de HLA-B5.6
Otras enfermedades autoinmunitarias
En el complejo de esclerosis sistémica, existe la asociación de susceptibilidad del HLA-DRB1*04:11 con la esclerodermia limitada (morfea), a pesar de la alta prevalencia de este alelo en la población general mexicana. Distinto a la morfea, en pacientes con esclerosis sistémica se ha asociado al HLA-DR5, lo que sugiere que el mecanismo de autoinmunidad es distinto en estas enfermedades.7
Otras enfermedades autoinmunitarias de la piel se han vinculado con alelos de susceptibilidad en la población mestiza mexicana, en el pénfigo con el HLA-DR14 (DR6) y HLA-DR1; el prurigo actínico con HLA-DR4.8,9,10 En el caso del vitíligo, Orozco-Topete y colaboradores encontraron que pacientes con enfermedad tiroidea de origen autoinmunitario con HLA-DRB1*04 tienen más riesgo de padecer vitíligo y que el alelo HLA-DRB1*08 les proporciona protección.11
Liquen plano
La causa del liquen plano aún se desconoce, se plantea de origen autoinmunitario. Distintos estudios han encontrado una asociación entre liquen plano y HLA-DR1, DR2, DR3, DR9 y DR10 en diferentes poblaciones. En México se ha asociado de forma significativa el HLA-DRB1*0101 y liquen plano en pacientes mestizos mexicanos, lo que confirma los datos informados en estudios previos. También se ha visto que los pacientes con HLA-DRB1*0101 negativos tienen alelos específicos de enfermedades autoinmunitarias, particularmente DRB1*15, DRB1*04 y DRB1*14. Esta observación apoya las teorías de un origen predominantemente autoinmunitario.12
HLA EN ENFERMEDADES INFLAMATORIAS
HLA-CW1 y psoriasis
La psoriasis es una enfermedad que se caracteriza por inflamación celular en la epidermis en donde se altera la diferenciación de los queratinocitos. Esta inflamación está mediada por el HLA C que se encarga de presentar antígenos a los linfocitos T-CD8+ que después migran a la epidermis, donde, al interactuar con los linfocitos T natural killer, median la respuesta inflamatoria. Entre los diferentes haplotipos que confieren susceptibilidad a la psoriasis, el HLA-CW6 es el que mayor riesgo confiere. El HLA-CW6 se ha asociado sobre todo en poblaciones caucásicas, en contraste con el HLA CW1, vinculado en poblaciones asiáticas. A su vez, el HLA CW1 se ha relacionado con psoriasis eritrodérmica, psoriasis pustular y psoriasis artrítica de tipo axial que no responde a tratamientos convencionales.13
Dermatitis cenicienta
La dermatitis cenicienta, también conocida como eritema discrómico perstans, es una enfermedad benigna adquirida. La causa aún no está clara, pero probablemente tenga una base inmunológica. En 2007, Carrillo-Correa y colaboradores describieron que las personas con HLA-DR4 tienen 6 veces más riesgo de padecer dermatitis cenicienta y con el subtipo HLA-DRB*0407 7 veces más riesgo que la población que no la presenta. Esto puede ser importante debido a su papel en la susceptibilidad al riesgo de los mestizos mexicanos de padecer dermatitis cenicienta. Ellos sugieren que podría ser un marcador de riesgo de la enfermedad o un indicador étnico.14
HLA EN ENFERMEDADES INFECCIOSAS
Micosis superficiales y profundas
En 2018 Estrada-Chávez y su grupo estudiaron a 9 personas con diagnóstico de esporotricosis en El Durazno, Guerrero; sus muestras se compararon con 50 controles locales. En ese estudio encontraron que, comparada con mestizos mexicanos de la Ciudad de México, la población de El Durazno tenía mayor prevalencia de HLA-DRB1*04:01 y que en los pacientes enfermos el HLA-DRB1*04:01 y el HLA-DRB1*08:02 era 2 veces más alto en la población local. Este último alelo, HLA-DRB1*08:02, también se ha asociado en mestizos mexicanos con susceptibilidad genética de onicomicosis y otras micosis superficiales por dermatofitos. Al contrario, se ha encontrado que el HLA-DR6 confiere protección contra la aparición de onicomicosis.15,16
Lepra
A pesar de la introducción de la terapia con múltiples medicamentos y la reducción general de la prevalencia de la lepra en México, la enfermedad sigue siendo endémica en ciertas regiones del país. En México se ha demostrado que el alelo HLA-DRB1*01 se asocia con la lepra lepromatosa y dimorfa y que la frecuencia del alelo HLA-DRB1*08 es significativamente menor entre los pacientes con lepra en comparación con los controles sanos.17
Virales
Virus del papiloma humano
Verrugas virales. La infección por el virus del papiloma humano depende de diversos factores, por lo que la aparición de la infección y la respuesta al tratamiento son variables en cada persona. En casos raros, las verrugas son de alivio espontáneo; algunos pacientes responden adecuadamente al tratamiento, mientras que otros son resistentes. La función de los genes del MHC es la presentación de péptidos derivados de antígenos infecciosos. En el Hospital General Dr. Manuel Gea González se estudió a 52 pacientes con verrugas virales y se encontró aumento en la frecuencia de los alelos HLA-DR3 y HLA-DR9, con disminución significativa del HLA-DR6, lo que sugiere un factor de protección.18
Hiperplasia epitelial focal. La hiperplasia epitelial focal (HEF) es una enfermedad proliferativa poco común de la mucosa oral, causada por los serotipos 13 y 32 del virus del papiloma humano (VPH). Los factores que determinan la susceptibilidad a la hiperplasia epitelial focal y su transmisión aún se desconocen, pero existe tendencia en ciertos grupos étnicos, además, la existencia de más de un caso de hiperplasia epitelial focal en la misma familia sugiere que la predisposición genética puede estar implicada en la patogenia de esta enfermedad. En 2005, García-Corona y colaboradores propusieron una hipótesis de que el locus HLA-DR participa en la fisiopatología de la hiperplasia epitelial focal al seleccionar individuos genéticamente susceptibles, particularmente los homocigotos para HLA-DR4 (subtipos DRB1*0404), que tienen ciertas secuencias de aminoácidos en la tercera región hipervariable. Esta secuencia de aminoácidos restringe a su vez la presentación antigénica de los péptidos derivados de la cápside viral a los linfocitos T CD4 y, en consecuencia, produce acumulación de estos péptidos en el interior de la célula, generando así la imagen de células “mitosoides”. La existencia del HLA-DRB1*04:04 sugiere que las poblaciones amerindias están en riesgo, ya que este alelo es relativamente frecuente en la población mexicana (tanto mestiza como amerindia).19
COVID-19
La región HLA se ha reconocido por su importancia en riesgo y resistencia. El estudio de diferentes enfermedades virales infecto-contagiosas (influenza, VIH, hepatitis C, rubéola) y de su relación con el tipo de HLA ha podido determinar los haplotipos que son inmunosusceptibles o inmunorresistentes. De esta manera, se piensa que hay una relación directa entre HLA y COVID-19 porque se ha observado diferente respuesta inmunitaria en casos moderados y graves de COVID-19, incluyendo respuesta tardía IgM y titulación IgG anti-proteína S. Esta variación en la titulación de anticuerpos podría depender del HLA; sin embargo, aún es necesario esclarecer la posibilidad de que esta diferencia de titulación sea dada con base en la inmunidad recibida por parte de las vacunas anti-SARS-CoV-2.20
HLA Y CÁNCER DE PIEL
Melanoma
Como sabemos, el melanoma es un tumor maligno de estirpe melanocítica. Al contrario de las estadísticas mundiales, el melanoma acral lentiginoso es el más frecuente en México. En 2020, Roldan-Marín y su grupo, compararon las frecuencias alélicas de HLA clase II en pacientes mestizos mexicanos con melanoma acral lentiginoso con las frecuencias presentadas en individuos sanos. Encontraron que los HLA-DRB1*13:01, HLA-DQA1*01:03 y HL-DQB1*02:02, confieren susceptibilidad a padecer melanoma acral lentiginoso en pacientes mestizos mexicanos. Los alelos de susceptibilidad HLA difieren entre los subtipos de melanoma, lo que sugiere diferencias en el mecanismo inmunopatológico.21
CONCLUSIONES
Como se discutió en este editorial, el HLA siempre se ha utilizado para diferenciar entre poblaciones enfermas y sanas. La susceptibilidad o protección dada por estos genes depende de la etnicidad y el mestizaje, por lo que la combinación de genes responsables varía de acuerdo con la población estudiada.
La mayor comprensión de la genética de las enfermedades autoinmunitarias puede tener un efecto en los diagnósticos tempranos y en un árbol de toma de decisiones para la intervención terapéutica.
REFERENCIAS
1. Dendrou CA, Petersen J, Rossjohn J, Fugger L. HLA variation and disease. Nat Rev Immunol 2018; 18 (5): 325-39. https://doi.org/10.1038/nri.2017.143
2. Ghodke Y, Joshi K, Chopra A, Patwardhan B. HLA and disease. Eur J Epidemiol 2005; 20 (6): 475-88. doi: 10.1007/s10654-005-5081-x.
3. Hernández-Doño S, Jakez-Ocampo J, Márquez-García JE, Ruiz D, Acuña-Alonzo V, Lima G, et al. Heterogeneity of genetic admixture determines SLE susceptibility in Mexican. Front Genet 2021; 12 (701373). https://doi.org/10.3389/fgene.2021.701373.
4. Moreno-Estrada A, R Gignoux C, Fernández-López JC, Zakharia F, Zikora M. Human genetics. The genetics of Mexico recapitulates Native American substructure and affects biomedical traits. Science 2014; 344 (6189): 1280-5. doi: 10.1126/science.1251688.
5. Granados J, Zúñiga J, Acuña-Alonzo V, Rosetti F, Vargas-Alarcón G. Influencia de alelos y haplotipos del complejo principal de histocompatibilidad en la susceptibilidad a lupus eritematoso generalizado en la población mexicana. Gac Med Mex 2006; 142 (3): 195-9.
6. Martí-Masanet M, Calvo-Penadés I. Poliarteritis nodosa. Otras vasculitis. Clasificación. Protoc Diagn Ter Peditr SERPE 2020; 2 (2): 271-83.
7. Rebollo-Domínguez N, Vega-Memije M-E, Villaseñor-Ovies P, García-Lechuga M, Granados J, Rangel-Gamboa L. Mayor histocompatibility complex class II (HLA-DR) is associated with morphea and systemic sclerosis patients. Blood Genomics 2018; 2 (3): 165-70. http://dx.doi.org/10.46701/APJBG.2018032018124.
8. Rangel-Gamboa L, Vega-Memije ME, Acuña-Alonzo V, Granados J. HLA clase II en pacientes mexicanos con pénfigo vulgar: epítopo compartido para autoinmunidad. Gac Med Mex 2016; 152: 587-91.
9. Vega-Memije ME, Sáez de Ocariz-Gutiérrez MM, Cortés-Franco R, Domínguez-Soto L, Granados J. Análisis del HLA-DR en pacientes mexicanos con pénfigo. Gac Med Mex 2001; 137: 535-540.
10. Hojyo-Tomoka T, Vega-Memije E, Granados J, Flores O, Cortés-Franco R, Teixeira F, et al. Actinic prurigo: an update. Int J Dermatol 1995; 34 (6): 380-4. doi: 10.1111/j.1365-4362.1995.tb04435.x.
11. Orozco-Topete R, Córdova-López J, Yamamoto-Furusho JK, García-Benitez V, López-Martínez A, Granados J. HLA-DRB1*04 is associated with the genetic susceptibility to develop vitiligo in Mexican patients with autoimmune thyroid disease. J Am Acad Dermatol 2005; 52 (1): 182-3. doi: 10.1016/j.jaad.2004.07.005.
12. Luis-Montoya P, Yamamoto-Furusho JK, Vega-Memije E, Rodríguez-Carreón A, Ruiz-Morales JA, Vargas-Alarcón G, et al. HLA-DRB1*0101 is associated with the genetic susceptibility to develop lichen planus in the Mexican Mestizo population. Arch Dermatol Res 2007; 299 (8): 405-7. doi: 10.1007/s00403-007-0769-2.
13. Huang Y-W, Tsai T-F. HLA-Cw1 and psoriasis. Am J Clin Dermatol 2021; 22 (3): 339-47. doi: 10.1007/s40257-020-00585-1.
14. Correa MC, Vega-Memije E, Vargas-Alarcón G, Guzmán RA, Rosetti F, Acuña-Alonzo V, et al. HLA-DR association with the genetic susceptibility to develop ashy dermatosis in Mexican Mestizo patients. J Am Acad Dermatol 2007; 56 (4): 617-20. doi: 10.1016/j.jaad.2006.08.062.
15. Asz-Sigall D, López-García L, Vega-Memije ME, Lacy-Niebla RM, García-Corona C, Ramírez-Rentería C, et al. HLA-DR6 association confers increased resistance to T. rubrum onychomycosis in Mexican Mestizos. Int J Dermatol 2010; 49 (12): 1406-9. doi: 10.1111/j.1365-4632.2010.04550.x.
16. Carrillo-Meléndrez H, Ortega-Hernández E, Granados J, Arroyo S, Barquera R, Arenas R. Role of HLA-DR alleles to increase genetic susceptibility to onychomycosis in nail psoriasis. Skin Append Dis 2016; 2 (1-2): 22-5. doi: 10.1159/000446444.
17. Escamilla-Tilch M, Torres-Carrillo NM, Payan RR, Aguilar-Medina M, Salazar MI, Fafutis-Morris M, et al. Association of genetic polymorphism of HLA-DRB1 antigens with the susceptibility to lepromatous leprosy. Biomed Rep 2013; 1 (6): 945-9. doi: 10.3892/br.2013.167.
18. García-Corona C, Vega-Memije E, Barquera R, Granados J. HLA-DR alleles associated with skin warts induced by human papillomavirus infection. Int J Dermatol 2010; 49 (12): 1376-9. doi: 10.1111/j.1365-4632.2010.04599.x.
19. García-Corona C, Vega-Memije E, Mosqueda-Taylor A, Yamamoto-Furusho JK, Rodríguez-Carreón AA, Ruiz-Morales JA, et al. Association of HLA-DR4 (DRB1*0404) with human papillomavirus infection in patients with focal epithelial hyperplasia. Arch Dermatol 2004; 140 (10): 1227-31. doi: 10.1001/archderm.140.10.1227.
20. Ovsyannikova IG, Haralambieva IH, Crooke SN, Poland GA, Kennedy RB. The role of host genetics in the immune response to SARS‐CoV‐2 and COVID‐19 susceptibility and severity. Immunol Rev 2020; 296 (1): 205-19. doi: 10.1111/imr.12897.
21. Roldan-Marin R, Rangel-Gamboa L, Vega-Memije ME, Hernández-Doño S, Ruiz-Gómez D, Granados J. Human leukocyte antigen Class II alleles associated with acral lentiginous melanoma in Mexican Mestizo patients: A case-control study. Indian J Dermatol Venereol Leprol 2021; 28: 1-7. doi: 10.25259/IJDVL_627_19.
Recibido: junio 2022
Aceptado: junio 2022
Este artículo debe citarse como: Granados J, Ruiz-Gómez D, Llanos-Rodríguez JF, Hernández-Doño S. HLA en la dermatología mexicana. Dermatol Rev Mex 2022; 66 (4): 469-476.