Dermatol Rev Mex. 2025; 69 (6): 919-922. https://doi.org/10.24245/dermatolrevmex.v69i6.10853
Mildred Dorta M,1 Liliana Rosales,1 Sandra Vivas Toro2
1 Residente de tercer año del posgrado de dermatología.
2 Médica internista-dermatóloga. Jefa del servicio de Dermatología. Profesora titular de la Escuela de Medicina y coordinadora del posgrado de Dermatología.
Ciudad hospitalaria Dr. Enrique Tejera, Universidad de Carabobo, Valencia, Venezuela.
CASO CLÍNICO
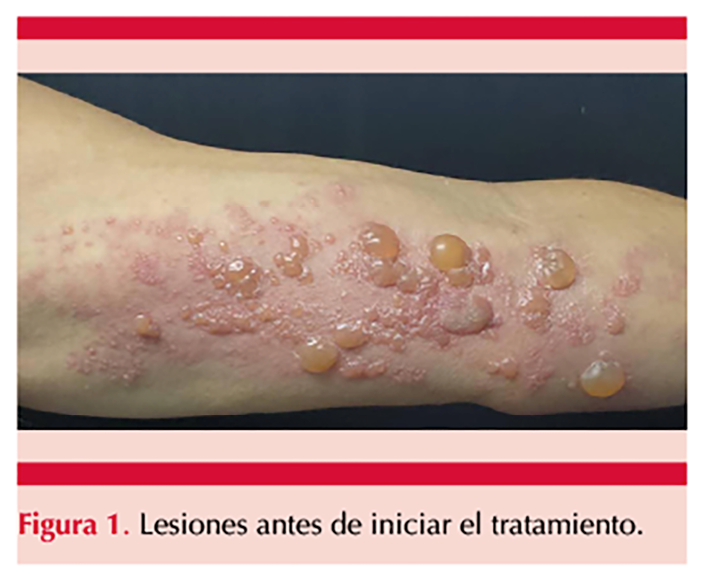
Paciente masculino de 60 años, con fototipo cutáneo IV-VI según la escala de Fitzpatrick, quien tenía antecedente de infección por SARS-CoV-2 hacía 6 meses. Manifestó una dermatosis localizada en el miembro superior izquierdo, caracterizada por vesículas y ampollas tensas, dolorosas, pruriginosas, de siete días de evolución. Figura 1
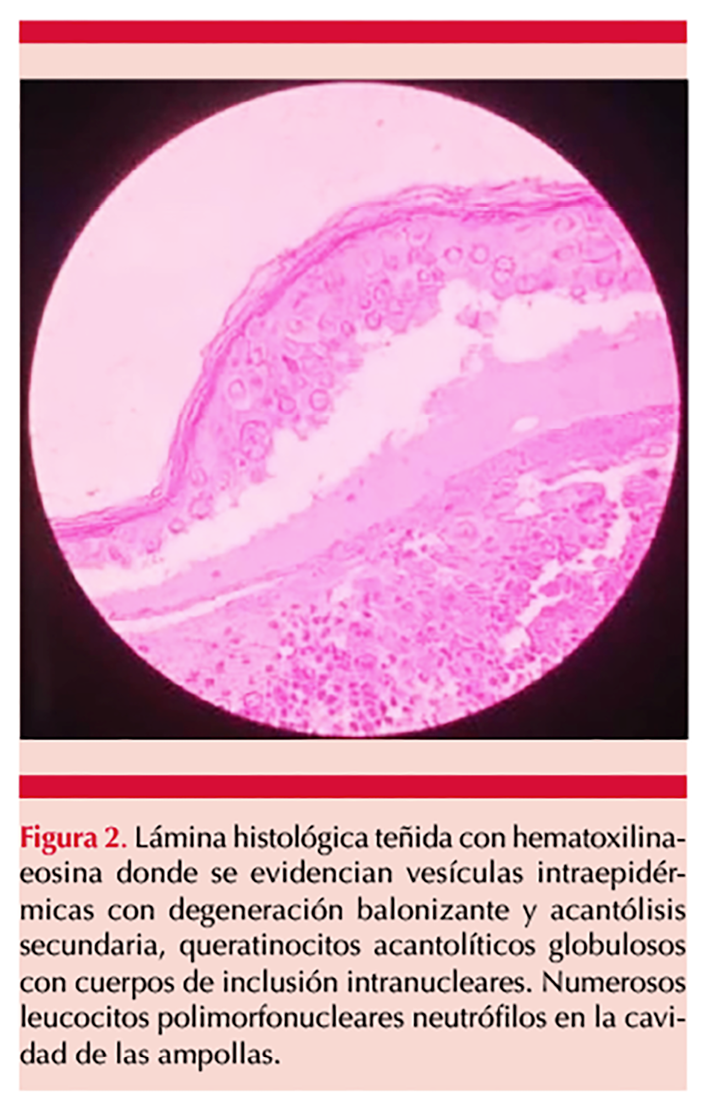
Había recibido 2 dosis de la vacuna contra el SARS-CoV-2 (Sinopharm-VeroCell); la primera hacía 8 meses y la segunda hacía 4 meses, después de curarse de la infección por SARS-CoV-2. Negó antecedentes de diabetes mellitus e hipertensión arterial. Se tomó biopsia incisional cuyo estudio reportó hallazgos histológicos compatibles con dermatitis con patrón de eritema multiforme secundaria a infección por herpes zoster. Figura 2
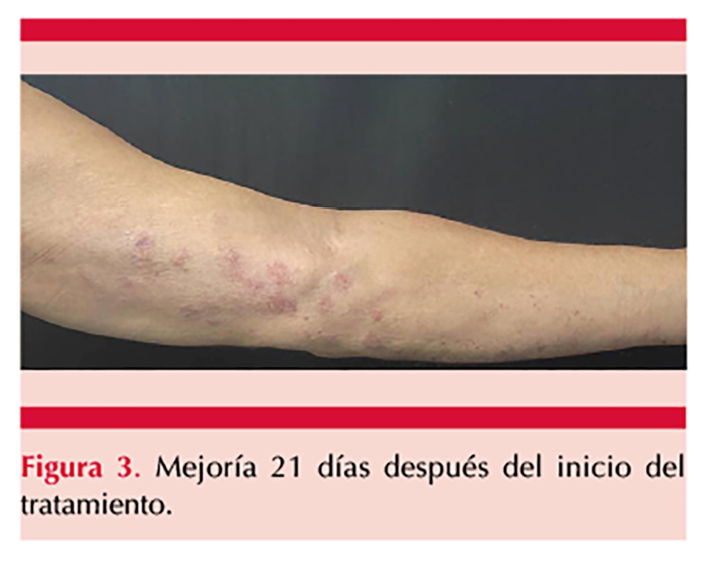
Recibió tratamiento con aciclovir a dosis de 800 mg vía oral cada 6 horas durante 14 días, aciclovir tópico durante 14 días y pregabalina 75 mg OD, con lo que se obtuvo alivio satisfactorio del cuadro clínico. Figura 3
DISCUSIÓN
El herpes zoster es una enfermedad producida por una reactivación del virus latente varicela zoster, que afecta los nervios periféricos y la piel, donde puede producir pequeñas ampollas dolorosas en forma de anillo agrupadas a lo largo de la zona de distribución del nervio (dermatoma).1
Su incidencia aproximada mundial es del 13% (491 millones de personas); el grupo etario más afectado es el de 15 a 49 años. En Venezuela la incidencia de esta enfermedad es del 15 al 20%. Se produce por la reactivación del virus varicela zoster que, tras la infección primaria, se encuentra en estado de latencia en los ganglios de los nervios raquídeos posteriores y en los ganglios sensitivos de los pares craneales.2,3
El cuadro clínico se caracteriza por múltiples vesículas agrupadas en ramillete que se asientan sobre una base eritematosa y se disponen en uno o más dermatomas. Los que se afectan con mayor frecuencia son los de localización torácica, seguidos por el trigémino, los lumbares, los cervicales y la región sacra. Las lesiones cutáneas suelen ser unilaterales. En el 80% de los casos, la erupción es precedida por dolor en el área afectada; algunos pacientes pueden referir astenia, decaimiento, fiebre o cefalea.1 El diagnóstico es clínico; sólo ante dudas diagnósticas se sugiere llevar a cabo las técnicas de diagnóstico disponibles en la actualidad: citodiagnóstico de Tzanck, inmunofluorescencia directa y prueba de PCR.
A finales de 2019 se reportó un brote de neumonía atípica en Wuhan, China, que se describió como un síndrome respiratorio agudo grave. Los primeros estudios epidemiológicos encontraron que la enfermedad se propaga de manera rápida y agresiva en adultos de entre 30 y 79 años. El agente causal es el virus del síndrome respiratorio agudo severo tipo 2 (SARS-CoV-2), causante de la enfermedad por coronavirus de 2019.4,5
Pese a los beneficios que proporcionan las vacunas, se han reportado complicaciones asociadas, como la reactivación del virus varicela zoster.6 Existe información clínica que reporta esta reactivación del virus varicela zoster como consecuencia de la respuesta inmunológica producida por la vacunación recibida a fin de combatir enfermedades como la hepatitis A, influenza, rabia, encefalitis japonesa y el COVID-19.7
Algunos estudios tratan de vincular la infección por herpes virus y la vacuna contra el SARS-CoV-2. La búsqueda arrojó un total de 54 pacientes, 27 hombres y 27 mujeres. Se informaron casos en todo el mundo: Estados Unidos, Líbano, Grecia, Italia, India, Israel, Finlandia, Taiwán, España y Portugal. Hubo casos con factores de riesgo conocidos para el herpes zoster: edad mayor de 50 años, enfermedad crónica, malignidad y trastornos inmunológicos, metabólicos o psiquiátricos.
El periodo medio entre la vacunación contra el herpes zoster y COVID-19 fue de 7.64 (6.92) días. En la mayoría de los casos (52 de 54) sobrevino herpes zoster entre una y tres semanas después de la vacuna contra COVID-19; 29 de ellos aparecieron en la primera semana de vacunación, independientemente de la cantidad de dosis de vacuna. Sólo hubo un caso informado después del mes de la aplicación de la vacuna contra COVID-19. La mayoría de los pacientes (45 de 54) recibieron la vacuna de ARNm; 5 la vacuna contra COVID-19 inactivada y 4, un vector viral no replicante. De los 45 pacientes que recibieron la vacuna de ARNm, 36 manifestaron herpes zoster después de la dosis de preparación de la vacuna contra COVID-19. Todos los pacientes que recibieron la vacuna de vector viral no replicante manifestaron herpes zoster después de la primera dosis.3
Los efectos adversos más comunes a las vacunas son: dolor en el sitio de la inyección, fiebre, dolor de cabeza, náuseas y vómitos.4 Se cree que la infección ocurre como resultado de la supresión de la función de las células T por el COVID-19 y la disminución de la cantidad de linfocitos T.8
La OMS y los CDC han establecido métodos estándar para hacer evaluaciones de causalidad de instancias individuales de vigilancia de efectos adversos de las vacunas. Cuando ocurre un incidente durante el marco de tiempo definido para mayor riesgo, se dice que es “consistente con” una asociación causal. Según las directrices actualizadas de la OMS sobre las definiciones de causalidad, una asociación “probable” sugiere una relación temporal y la existencia de un mecanismo biológico para la asociación causal entre la vacunación y la ocurrencia.3
Los estudios inmunológicos, epidemiológicos y clínicos pueden ayudar a comprender la relación causa-efecto, pudiendo ser terapéuticamente relevantes para decidir si prescribir antivirales como profiláctico temporal antes de la inmunización en personas con mayor riesgo de reactivación del VZV después de la vacunación contra el SARS-CoV-2.9
El tratamiento de elección son los análogos de los nucleósidos, como el aciclovir (oral o intravenoso), el valaciclovir, el famciclovir y la brivudina, que inhiben la replicación de los virus herpes porque interfieren en la ADN polimerasa de éstos, y antidepresivos, como la amitriptilina, administrada en las primeras 48 horas desde el inicio del exantema, a dosis de 25 mg por la noche durante tres meses, con lo que se reduce la prevalencia de neuropatía a los seis meses, sobre todo en pacientes ancianos, aunque en éstos los efectos secundarios anticolinérgicos son más probables.
CONCLUSIONES
El paciente del caso coincide con las estadísticas epidemiológicas respecto del grupo etario de pacientes mayores de 50 años, pero no hay una casualidad o vínculo con la administración de la vacunación contra SARS-CoV-2 porque todos los trabajos revisados mencionan una probable asociación o causalidad de 7 a 42 días después de la aplicación de la vacuna. Los estudios clínicos epidemiológicos a gran escala pueden ayudar a aclarar la posible relación del herpes zoster con la inmunización contra el SARS-CoV-2.
REFERENCIAS
1. Marte-Colina IJ, Vivas-Toro SC. Reactivación de herpes virus en tiempos de pandemia por SARS-CoV-2. Dermatol Rev Mex 2022; 66 (4): 534-541. https://doi.org/10.24245/dermatolrevmex.v66i4.7935
2. Diez-Domingo J, Parikh R, Bhavsar AB, et al. ¿Puede COVID-19 aumentar el riesgo de herpes zóster? Una revisión narrativa. Dermatol Ther 2021; 11: 1119-1126.
3. Desai HD, Sharma K, Shah A, et al. ¿La vacuna contra el SARS-CoV-2 puede aumentar el riesgo de reactivación de ¿varicela zóster? Una revisión sistemática. J Cosmet Dermatol 2021; 20: 3350-3361. https://doi.org/10.1111/jocd.14521
4. Valverde-López J, Rodríguez-Saldaña J. Reactivación del virus varicela zóster tras la vacunación contra la COVID-19 [Reactivation of varicella zóster virus post Covid-19 vaccination]. Piel 2022; 37: S10-2. Spanish. https://doi.org/10.1016/j.piel.2022.03.007
5. Dçíaz F, Toro A. SARS-CoV-2/COVID-19: el virus, la enfermedad y la pandemia. Med Laboratorio 2020; 24 (3): 183-205.
6. Eid E, Abdullah L, Kurban M, Abbas O. Herpes zoster emergence following mRNA COVID-19 vaccine. J Med Virol 2021; 93 (9): 5231-5232. https://doi.org/10.1002/jmv.27036
7. Thonginnetra S, Limtanyakul P, Tawinprai K. Herpes zoster after COVID-19 vaccination in an adolescent. Dermatol Online J 2022; 28 (4). https://doi.org/10.5070/D328458533
8. Tessas I, Kluger N. Ipsilateral herpes zoster after the first dose of BNT162b2 mRNA COVID-19 vaccine. J Eur Acad Dermatol Venereol 2021; 35 (10): e620-e622. https://doi.org/10.1111/jdv.17422
Este artículo debe citarse como: Dorta MM, Rosales L, Vivas-Toro S. Herpes zoster posterior a SARS-CoV-2. Dermatol Rev Mex 2025; 69 (6): 919-922.