Subungual squamous cell carcinoma associated to HPV.
Dermatol Rev Mex. 2024; 68 (2): 269-274. https://doi.org/10.24245/drm/bmu.v68i2.8257
Lucía de Fátima Arroyo Garza,1 Jorge Alberto Guerra Villalobos,2 Elena Rosalía Arroyo Garza3
1 Servicio de Medicina Interna, Hospital General Saltillo, Saltillo, Coahuila.
2 Servicio de Dermatología, Hospital General de Zona núm. 6, IMSS, Ciudad Juárez, Chihuahua, México.
3 Departamento de Oftalmología, Centro Médico Barzilai, Ashkelon, Israel.
ANTECEDENTES
Es bien conocido el riesgo oncogénico que tiene el VPH en el carcinoma espinocelular en el área genital;1,2 sin embargo, poco se conoce de esta asociación en topografías distintas como las manos y los pies, particularmente en el área del lecho ungueal, donde le sigue en frecuencia.3
CASO CLÍNICO
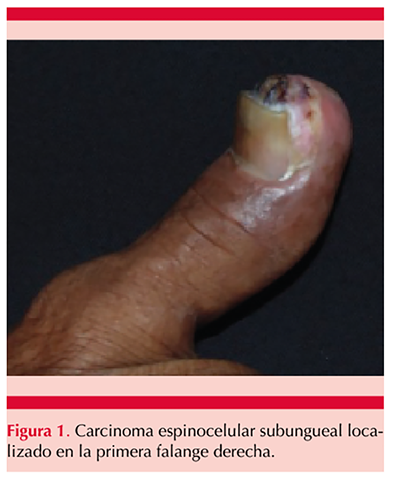
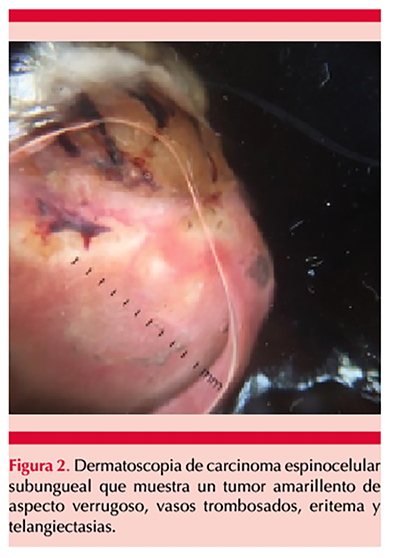
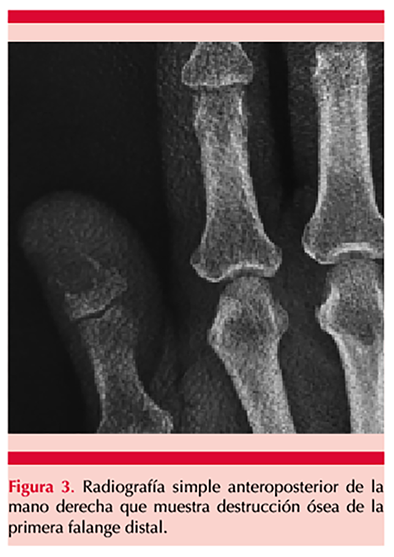
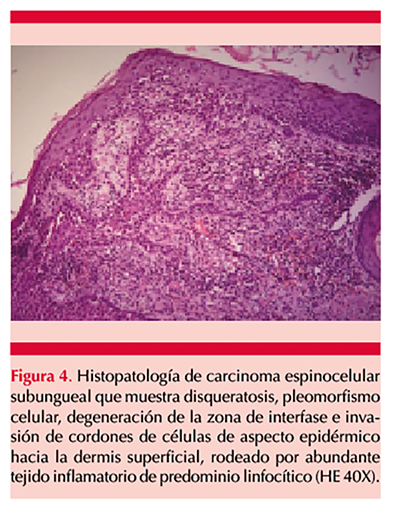
Paciente masculino de 67 años de edad con antecedente de tabaquismo de 12.5 paquetes/año; acudió a la consulta por padecer una dermatosis en primera falange derecha, asociada con hiperbaralgesia y sin respuesta a tratamiento antimicótico, de 2 meses de evolución. El paciente refirió traumatismo contuso en el dedo afectado 4 meses antes del inicio de su padecimiento. A la exploración física se encontró una dermatosis localizada a la porción distal de la primera falange derecha, subungueal, constituida por una tumoración verrugosa de 1.5 cm en su diámetro mayor, asimétrica, de color marrón amarillento, sobre fondo compuesto por eritema y áreas blanquecinas, de bordes poco precisos, que producía levantamiento del plato ungueal y de evolución aparentemente crónica (Figura 1). A la dermatoscopia se observó una tumoración amarillenta de 10 x 15 x 8 mm de diámetro, con vasos trombosados en su superficie, sobre un fondo eritematoso con telangiectasias (Figura 2). No se encontraron adenomegalias en el miembro superior ipsilateral y el resto de la exploración física fue normal. El estudio micológico directo, cultivo y tinción de Gram fueron negativos. Se tomó biopsia profunda por sacabocado de 3.5 mm de diámetro, con reporte histopatológico sugerente de verruga viral; sin embargo, la radiografía mostró destrucción ósea de la falange distal (Figura 3), por lo que se tomó una segunda biopsia incisional que evidenció disqueratosis, pleomorfismo celular, degeneración de la zona de interfase e invasión de cordones de células de aspecto epidérmico hacia la dermis superficial, rodeado por abundante tejido inflamatorio de predominio linfocítico (Figura 4), por lo que se diagnosticó carcinoma espinocelular subungueal bien diferenciado con invasión ósea y se refirió a un instituto especializado en cancerología donde se amputó la falange distal.
DISCUSIÓN
El carcinoma espinocelular, incluido el carcinoma espinocelular in situ (enfermedad de Bowen), del aparato ungueal es un tumor raro pero también la neoplasia maligna más común de la uña.4,5 Ocurre más frecuentemente en las uñas de las manos, con predilección por el tercer dedo.4,5,6 Es dos veces más predominante en el sexo masculino y es casi exclusivo de la edad adulta, siendo el diagnóstico más frecuente después de los 50 años de edad.3,4,5,7
Del 60 al 90% de los casos de carcinoma espinocelular y carcinoma espinocelular in situ del aparato ungueal en general se han reportado asociados con el VPH5,8,9 con un 47% de los casos vinculados con VPH de alto riesgo, predominantemente el subtipo 16 (57%), seguido de los subtipos 56 (9%), 73 (6%), 33 (5%) y 58 (3%).5 El resto de los subtipos que se han identificado en la bibliografía médica son los subtipos 2, 6, 9, 11, 17, 18, 21, 26, 31, 34, 35, 36, 39, 45, 49, 51, 52, 59, 67, 68, 82 y 84.5,10-22
Otros factores predisponentes de padecer esta neoplasia son los traumatismos, la exposición a radiación y tóxicos, el tabaquismo y la inmunosupresión.3,4 El paciente del caso comunicado tenía múltiples factores de riesgo: el antecedente de traumatismo y de tabaquismo importante y la infección por VPH. No se evaluó el subtipo de VPH.
Es importante que, una vez establecido el diagnóstico, se descarte la enfermedad genital relacionada con el VPH, que se ha encontrado en el 24% de los casos.5 Asimismo, debe advertirse al paciente del riesgo que existe de autoinoculación, demostrado también por el 8% de los casos reportados en que se han observado múltiples lesiones en los dedos, lo que sugiere la transmisibilidad de este virus.5
El carcinoma espinocelular y carcinoma espinocelular in situ ungueal en asociación con el VPH son más frecuentes en las uñas de las manos (80-90%) que en las de los pies4,5,7 y el dedo más comúnmente afectado es el tercero de la mano izquierda, seguido de los dedos 1-3 de la mano derecha.5 La mayor parte de las veces afecta el área periungueal (pliegue ungueal y surco ungueal), seguida del área subungueal (debajo del plato ungueal) con melanoniquia longitudinal (caracterizada por una raya pigmentada del plato ungueal y de tipo subungueal) y, por último, de una combinación del área periungueal y subungueal con melanoniquia longitudinal.5 La mayor parte de estos tumores se han encontrado en la mano no dominante (62%).4
Su amplia e inespecífica manifestación clínica suele ser similar a otras onicopatías, siendo frecuentemente mal diagnosticado por enfermedades benignas, como verrugas virales y onicomicosis.3,5,7,23 El lento crecimiento del tumor también contribuye al retraso del diagnóstico, el cual es, en promedio, de 3.2 a 5.3 años desde el inicio de los síntomas.3,4
El espectro clínico de manifestación es extenso e incluye el de una masa verrugosa, melanoniquia y eritroniquia longitudinales, leuconiquia, hiperqueratosis subungueal, hemorragia subungueal, traquioniquia, nódulos subungueales, onicólisis y paroniquia.3,5,7,8
Un pequeño porcentaje de pacientes con carcinoma espinocelular de los dedos relacionados con el VPH están inmunosuprimidos (6.8%), por lo que no es una enfermedad exclusiva del VIH, de pacientes con antecedente de trasplante de órganos o con cánceres hematológicos.3
La realización de cultivos micológicos no es útil para descartar un carcinoma espinocelular, ya que hay casos reportados en los que existe una infección micótica sobreagregada.7 Por este motivo, la biopsia es el único estudio diagnóstico específico. Los marcadores tumorales Ki-67 y p16INK4A podrían ser de utilidad para el diagnóstico de carcinoma espinocelular digital asociado con el VPH debido a que existe evidencia de mayor expresión de los mismos en el carcinoma espinocelular digital asociado con este virus que en el no asociado con el VPH.3 No obstante, se requieren más estudios para definir su valor costo-beneficio.3 La radiografía de la falange afectada deberá hacerse sistemáticamente y, en casos dudosos, podrá indicarse una resonancia magnética.7 La amputación estará indicada siempre que haya invasión ósea evidenciada por estudio de imagen; no hay indicación para la cirugía de Mohs en estos casos.7 En el caso comunicado, además de la sospecha clínica de un carcinoma espinocelular, el hallazgo radiológico obligó a la realización de una segunda biopsia, por lo que su toma de manera sistemática es costo-efectiva. Además de la invasión ósea, son también los tumores mal diferenciados predictores para una cirugía de Mohs incompleta y metástasis, la cual se ha reportado en el 2 al 3%.3
El tratamiento más exitoso de estos tumores sin daño óseo es la cirugía micrográfica de Mohs. Su tasa de recurrencia es variable, va del 0 al 23% en el carcinoma espinocelular invasivo, comparado con una tasa de recurrencia del 3% en los carcinomas espinocelulares cutáneos después de este tratamiento.3,4,5,7,9,24,25,26 Esta discrepancia en las tasas de curación puede explicarse debido a la mayor dificultad quirúrgica en esta área anatómica y a que gran parte de los carcinomas espinocelulares ungueales están asociados con VPH de alto riesgo. Incluso después de conseguir márgenes libres de tumor posterior al tratamiento con cirugía de Mohs, células positivas de VPH permanecen en el tejido ungueal y periungueal que pueden desencadenar mutaciones oncogénicas.4
La mayoría de los casos de carcinoma espinocelular ungueal in situ han sido tratados con escisión quirúrgica, con una tasa de recurrencia del 33%.5 El carcinoma espinocelular y el carcinoma espinocelular ungueal in situ lejos del lecho ungueal y particularmente en el pliegue ungueal proximal e hiponiquio han demostrado predilección por afectar profundamente los surcos ungueales laterales, así como por extenderse al periostio, sin invasión de la membrana basal en los casos in situ. Con esto, se ha propuesto la denominación de estas dos afecciones como una sola, con un algoritmo terapéutico compartido.7 El examen histopatológico de los márgenes es obligatorio independientemente de la modalidad quirúrgica efectuada.7
Otras modalidades terapéuticas que se han usado con resultados alentadores pero variables son la terapia con radiación, la terapia fotodinámica y la administración de imiquimod. Sin embargo, se requiere mayor estudio en la materia, por lo que no son consideradas de primera línea.5,7
CONCLUSIONES
El carcinoma espinocelular, incluido el carcinoma espinocelular in situ ungueal es una neoplasia poco frecuente que predomina en varones adultos, asociada la mayor parte de las veces con VPH, frecuentemente con subtipos de alto riesgo. Debido a su amplia e inespecífica manifestación clínica y al alto porcentaje de recurrencia posquirúrgica, continúa siendo un reto diagnóstico y terapéutico. La toma de radiografía de manera sistemática es obligatoria, ya que permite identificar el daño óseo y detectar casos previamente excluidos por histopatología.
REFERENCIAS
1. Tjalma WA, Van Waes TR, Van den Eeden LE, Bogers JJ. Role of human papillomavirus in the carcinogenesis of squamous cell carcinoma and adenocarcinoma of the cervix. Best Pract Res Clin Obstet Gynaecol 2005; 19 (4): 469-483. doi:10.1016/j.bpobgyn.2005.02.002.
2. de Sanjose S, Quint WG, Alemany L, Geraets DT, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol 2010; 11 (11): 1048-1056. doi:10.1016/S1470-2045(10)70230-8.
3. Riddel C, Rashid R, Thomas V. Ungual and periungual human papillomavirus-associated squamous cell carcinoma: a review. J Am Acad Dermatol 2011; 64 (6): 1147-1153. doi:10.1016/j.jaad.2010.02.057.
4. Tang N, Maloney ME, Clark AH, Jellinek NJ. A retrospective study of nail squamous cell carcinoma at 2 institutions. Dermatol Surg 2016; 42 Suppl 1: S8-S17. doi:10.1097/DSS.0000000000000521.
5. Shimizu A, Kuriyama Y, Hasegawa M, Tamura A, Ishikawa O. Nail squamous cell carcinoma: A hidden high-risk human papillomavirus reservoir for sexually transmitted infections. J Am Acad Dermatol 2019; 81 (6): 1358-1370. doi:10.1016/j.jaad.2019.03.070.
6. Zabawski EJ Jr, Washak RV, Cohen JB, Cockerell CJ, Brown SM. Squamous cell carcinoma of the nail bed: is finger predominance another clue to etiology? A report of 5 cases. Cutis 2001; 67 (1): 59-64.
7. Dalle S, Depape L, Phan A, Balme B, Ronger-Savle S, Thomas L. Squamous cell carcinoma of the nail apparatus: clinicopathological study of 35 cases. Br J Dermatol 2007; 156 (5): 871-874. doi:10.1111/j.1365-2133.2006.07744.x.
8. Sass U, André J, Stene JJ, Noel JC. Longitudinal melanonychia revealing an intraepidermal carcinoma of the nail apparatus: detection of integrated HPV-16 DNA. J Am Acad Dermatol 1998; 39 (3): 490-493. doi:10.1016/s0190-9622(98)70331-7.
9. Alam M, Caldwell JB, Eliezri YD. Human papillomavirus-associated digital squamous cell carcinoma: literature review and report of 21 new cases. J Am Acad Dermatol 2003; 48 (3): 385-393. doi:10.1067/mjd.2003.184.
10. Forslund O, Nordin P, Andersson K, Stenquist B, Hansson BG. DNA analysis indicates patient-specific human papillomavirus type 16 strains in Bowen’s disease on fingers and in archival samples from genital dysplasia. Br J Dermatol 1997; 136 (5): 678-682.
11. Lambiase MC, Gardner TL, Altman CE, Albertini JG. Bowen disease of the nail bed presenting as longitudinal melanonychia: detection of human papillomavirus type 56 DNA. Cutis 2003; 72 (4): 305-296.
12. Moy RL, Eliezri YD, Nuovo GJ, Zitelli JA, Bennett RG, Silverstein S. Human papillomavirus type 16 DNA in periungual squamous cell carcinomas. JAMA 1989; 261 (18): 2669-2673.
13. Rüdlinger R, Grob R, Yu YX, Schnyder UW. Human papillomavirus-35-positive bowenoid papulosis of the anogenital area and concurrent human papillomavirus-35-positive verruca with Bowenoid dysplasia of the periungual area. Arch Dermatol 1989; 125 (5): 655-659. doi:10.1001/archderm.1989.01670170069012.
14. Sass U, André J, Stene JJ, Noel JC. Longitudinal melanonychia revealing an intraepidermal carcinoma of the nail apparatus: detection of integrated HPV-16 DNA. J Am Acad Dermatol 1998; 39 (3): 490-493. doi:10.1016/s0190-9622(98)70331-7.
15. Kreuter A, Gambichler T, Pfister H, Wieland U. Diversity of human papillomavirus types in periungual squamous cell carcinoma. Br J Dermatol 2009; 161 (6): 1262-1269. doi:10.1111/j.1365-2133.2009.09343.x.
16. Donati P, Muscardin L, Amantea A, Paolini F, Venuti A. Detection of HPV-15 in painful subungual tumors of incontinentia pigmenti: successful topical therapy with retinoic acid. Eur J Dermatol 2009; 19 (3): 243-247. doi:10.1684/ejd.2009.0629.
17. Turowski CB, Ross AS, Cusack CA. Human papillomavirus-associated squamous cell carcinoma of the nail bed in African-American patients. Int J Dermatol 2009; 48 (2): 117-120. doi:10.1111/j.1365-4632.2009.03450.x.
18. Shimizu A, Tamura A, Abe M, et al. Detection of human papillomavirus type 56 in Bowen’s disease involving the nail matrix. Br J Dermatol 2008; 158 (6): 1273-1279. doi:10.1111/j.1365-2133.2008.08562.x.
19. Handisurya A, Rieger A, Bankier A, Koller A, et al. Human papillomavirus type 26 infection causing multiple invasive squamous cell carcinomas of the fingernails in an AIDS patient under highly active antiretroviral therapy. [published correction appears in Br J Dermatol 2007; 157 (6): 1304]. Br J Dermatol 2007; 157 (4): 788-794. doi:10.1111/j.1365-2133.2007.08094.x.
20. High WA, Tyring SK, Taylor RS. Rapidly enlarging growth of the proximal nail fold. Dermatol Surg 2003; 29 (9): 984-986. doi:10.1046/j.1524-4725.2003.29266.x.
21. Theunis A, André J, Noël JC. Evaluation of the role of genital human papillomavirus in the pathogenesis of ungual squamous cell carcinoma. Dermatology 1999; 198 (2): 206-208. doi:10.1159/000018114.
22. Guitart J, Bergfeld WF, Tuthill RJ, Tubbs RR, Zienowicz R, Fleegler EJ. Squamous cell carcinoma of the nail bed: a clinicopathological study of 12 cases. Br J Dermatol 1990; 123 (2): 215-222. doi:10.1111/j.1365-2133.1990.tb01849.x.
23. Perruchoud DL, Varonier C, Haneke E, Hunger RE, et al. Bowen disease of the nail unit: a retrospective study of 12 cases and their association with human papillomaviruses. J Eur Acad Dermatol Venereol 2016; 30 (9): 1503-1506. doi:10.1111/jdv.13654.
24. Dika E, Piraccini BM, Balestri R, Vaccari S, et al. Mohs surgery for squamous cell carcinoma of the nail: report of 15 cases. Our experience and a long-term follow-up. Br J Dermatol 2012; 167 (6): 1310-1314. doi:10.1111/j.1365-2133.2012.11129.x.
25. Young LC, Tuxen AJ, Goodman G. Mohs’ micrographic surgery as treatment for squamous dysplasia of the nail unit. Australas J Dermatol 2012; 53 (2): 123-127. doi:10.1111/j.1440-0960.2011.00813.x.
26. Goldminz D, Bennett RG. Mohs micrographic surgery of the nail unit. J Dermatol Surg Oncol 1992; 18 (8): 721-726. doi:10.1111/j.1524-4725.1992.tb02006.x.
Recibido: febrero 2023
Aceptado: marzo 2023
Este artículo debe citarse como: Arroyo-Garza LF, Guerra-Villalobos JA, Arroyo-Garza ER. Carcinoma espinocelular subungueal asociado con VPH. Dermatol Rev Mex 2024; 68 (2): 269-274.

