Cutaneous mucormycosis: Is it frequent as a complication of hemophagocytic lymphohistiocytosis and multiple myeloma?
Dermatol Rev Mex. 2025; 69 (5): 745-749. https://doi.org/10.24245/dermatolrevmex.v69i5.10752
Mariana R Basurto Hurtado,1 Santiago M Menéndez Zertuche,2 Zaira L Clemente Callejas,3 Cristina Aguilar Mena,4 Alexandro Bonifaz4
1 Servicio de Medicina Interna.
2 Servicio de Otorrinolaringología.
3 Servicio de Microbiología.
Hospital General de Querétaro, Querétaro, México.
4 Servicio de Dermatología, Hospital General de México Dr. Eduardo Liceaga, Ciudad de México, México.
Estimado editor:
La mucormicosis es una infección fúngica oportunista con alta morbilidad y mortalidad debido al retraso en el diagnóstico y la evolución rápidamente progresiva. Es causada por hongos del orden Mucorales.1 Los factores predisponentes incluyen diabetes descompensada, neoplasias malignas hematológicas, trasplante hematopoyético o de órgano sólido, sobrecarga de hierro y administración de corticosteroides o fármacos citotóxicos;2 sin embargo, su asociación con mieloma múltiple o linfohistiocitosis hemofagocítica rara vez se reporta en la bibliografía.3-6 Por lo tanto, la asociación de estas enfermedades en este paciente es excepcional.
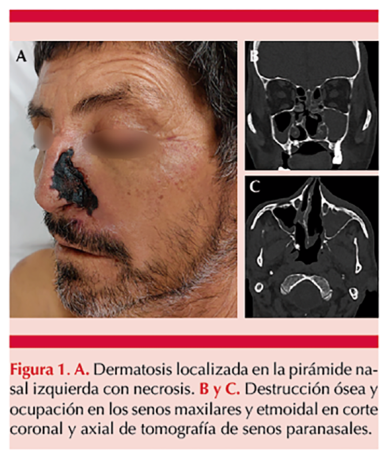
Paciente masculino de 57 años, de ocupación campesino, con antecedente de trastorno depresivo, diabetes tipo 2 y mieloma múltiple IgA estadio IIIB, diagnosticado un año previo a su ingreso, resistente a tratamiento de primera línea con radioterapia y quimioterapia con ciclofosfamida, dexametasona y talidomida, así como a segunda línea de tratamiento con quimioterapia con bortezomib, dexametasona y lenalidomida. Fue hospitalizado por un cuadro de epistaxis, ictericia y hepatoesplenomegalia, asociado con pancitopenia, hiperbilirrubinemia, elevación de enzimas hepáticas, hipofibrinogenemia, hiperferritinemia e hipergammaglobulinemia A (IgA 20,174 mg/dL), por lo que se inició soporte transfusional y tercera línea de tratamiento con carfilzomib, dexametasona y lenalidomida. Se agregaron episodios de fiebre intermitentes, con lo que cumplió criterios diagnósticos de linfohistiocitosis hemofagocítica, por lo que se inició daratumumab, ciclosporina y etopósido. Dos semanas después manifestó cefalea frontal, edema, hipertermia y dolor en la región hemifacial izquierda, que evolucionó a dermatosis localizada en la pirámide nasal izquierda, constituida por una placa eritematoviolácea, delimitada, con áreas de necrosis, rodeada de eritema y edema perilesional, misma que evolucionó a franca necrosis en las próximas 48 horas; afectaba también el paladar duro. Figura 1A
Se sospechó mucormicosis rinosinusal; la tomografía de cráneo para delimitar la extensión evidenció ocupación de los senos paranasales y destrucción etmoidal ósea. Figura 1B y C
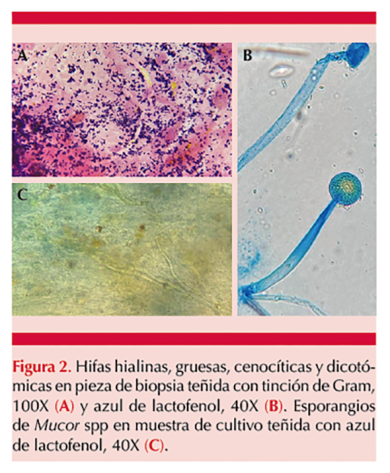
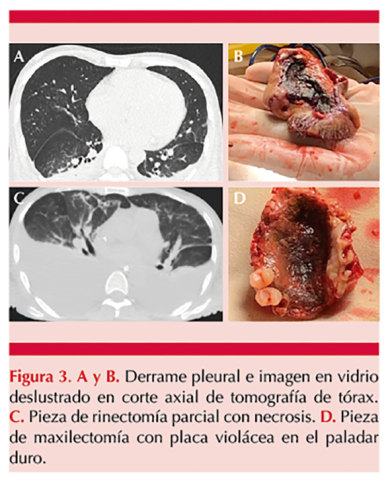
En el estudio de la biopsia de paladar se visualizaron hifas cenocíticas en tinción de Gram y azul de lactofenol (Figura 2A y B). Se inició tratamiento con anfotericina deoxicolato a dosis de 1 mg/kg/día. Posteriormente se reportó cultivo con desarrollo de Mucor spp (Figura 2C) e histopatología con evidencia de microorganismo compatible con mucormicosis con permeación vascular e inflamación crónica leve. El paciente tuvo insuficiencia respiratoria, por lo que requirió intubación orotraqual. La tomografía de tórax reveló derrame pleural e imagen en vidrio deslustrado de forma bilateral. Figura 3A y B
Aproximadamente 10 días después de la aparición de las lesiones se practicó rinectomía parcial y maxilectomía, una vez que mejoró el recuento plaquetario (Figura 3C y D); sin embargo, se agregó inestabilidad hemodinámica y lesión renal aguda, que culminó en su defunción a dos meses del ingreso hospitalario.
La mucormicosis tiene las siguientes manifestaciones clínicas en orden de frecuencia: rinocerebral, pulmonar, cutánea, gastrointestinal y diseminada.7 La cutánea, por lo general, inicia de forma secundaria a otras manifestaciones, o de forma primaria, a partir de un traumatismo que altera la barrera cutánea, como quemaduras o cirugías, entre otros.
En términos clínicos, se describe la formación de vesículas y pústulas que evolucionan a escara, y variedades con formación de una zona necrótica de margen eritematoso, con predisposición a celulitis y diseminación sistémica en caso de inmunosupresión.8 La localización habitualmente es en la cara, los párpados y el paladar en la forma secundaria y no específica en la primaria.7
La variedad rinocerebral se adquiere mediante la inhalación de esporangiosporas y se manifiesta con descarga nasal de olor fétido, dolor y edema facial unilateral, secreción ocular purulenta, que evolucionan a fístulas, úlceras necróticas, lesiones osteolíticas, afección de pares craneales y meningoenecefalitis.9
La diabetes mellitus es la principal enfermedad subyacente en la manifestación cutánea, se reporta en un 20% de los casos, seguida de neoplasias hematológicas en el 15%; la leucemia mieloide aguda y la leucemia linfoblástica aguda son las más frecuentes. No obstante, el 39.6% de los casos carecen de enfermedades subyacentes, de los que el 87% tienen el antecedente de un traumatismo.10 En México las dos enfermedades subyacentes más prevalentes en pacientes con mucormicosis son la diabetes mellitus (76.6%) y las neoplasias hematológicas (15.4%), mayormente leucemia linfocítica aguda.11 En contraste, en países industrializados, las neoplasias hematológicas representan el 50% de los casos, seguidas de diabetes mellitus (23%) y traumatismos (18%).12 Sin embargo, la asociación con mieloma múltiple o linfohistiocitosis hemofagocítica es poco frecuente y de mal pronóstico.3
Respecto del síndrome hemofagocítico o linfohistiocitosis hemofagocítica, hay dos casos reportados en población pediátrica con variedad diseminada y pulmonar4,5 y un caso en un paciente adulto con variedad diseminada, microangiopatía trombótica y linfoma.6
En términos fisiopatológicos influye la descompensación metabólica, la sobrecarga de hierro y el estado de inmunosupresión severa, principalmente asociado con neutropenia o disfunción de los neutrófilos, ya sea primaria o secundaria a la administración de fármacos citotóxicos. En estados de descompensación metabólica, como la cetoacidosis diabética, mayormente asociada con la forma rinocerebral, la hiperglucemia estimula el crecimiento fúngico, la cetosis altera la permeabilidad de la barrera hematoencefálica, permitiendo la diseminación del agente, y la acidosis (pH de 6.8 a 7.3) produce disociación del hierro férrico de proteínas como transferrina, ferritina, lactotransferrina y del grupo hemo a su forma libre o hierro ferroso (Fe3+ a Fe2+), que estimula el crecimiento fúngico. Por lo tanto, los pacientes multitransfundidos o con sobrecarga de hierro tienen mayor predisposición.
Estos factores también estimulan la unión de proteínas homólogas del recubrimiento de esporas (CotH) a la proteína 78 regulada por glucosa (GRP78), situada en el endotelio, lo que permite la angioinvasión, trombosis vascular y necrosis tisular. Los neutrófilos participan en la contención del patógeno y la producción de citocinas proinflamatorias, por lo que su disfunción o deficiencia es decisiva en la aparición de la enfermedad, que es frecuente en formas pulmonares o diseminadas.
La trombocitopenia también se ve implicada debido a que la adhesión plaquetaria a esporangiosporas e hifas inhibe la germinación fúngica.7 Si bien nuestro paciente contaba con el antecedente de diabetes, ésta no estaba descontrolada.
La sobrecarga de hierro y la neutropenia secundaria al mieloma múltiple, la administración de fármacos citotóxicos y la linfohistiocitosis hemofagocítica, caracterizada por hiperactivación inmunitaria debido a un defecto genético o adquirido en las células NK y linfocitos T, con falla en el aclaramiento antigénico y disminución de la regulación negativa de la respuesta inmunitaria,13,14 fueron los principales factores desencadenantes de la infección.
Los agentes etiológicos reportados con más frecuencia son Rhizopus spp, Mucor spp y Lichtheimia spp, con una variación geográfica considerable. En el paciente del caso se aisló Mucor spp, únicamente mediante identificación morfológica. El diagnóstico se sospecha con la visualización por microscopia directa y se confirma con la identificación histopatológica de invasión tisular por hifas no pigmentadas, de ancho variable, desde 6 a 25 μm, no septadas o pauciseptadas, con forma de cinta y patrón irregular de ramificación. El ángulo de ramificación de 90° y la ausencia de septos puede alterarse por la manipulación del tejido, por lo que se recomienda la complementación diagnóstica con cultivo, lo que además permite la identificación del género, la especie y la susceptibilidad del agente. Se sugiere también complementar el diagnóstico con estudios de extensión mediante tomografía computada o resonancia magnética de acuerdo con la sospecha clínica, con repetición semanal una vez establecido el diagnóstico.1 Los hallazgos típicos en la manifestación pulmonar son poco específicos, se distinguen por áreas de consolidación, signo del halo inverso, más de diez nódulos, cavitaciones, atelectasias, derrame pleural, linfadenopatía mediastinal o hiliar y engrosamiento traqueal posterior, con predominio en los lóbulos superiores y de forma bilateral.15 A pesar de las manifestaciones pulmonares, los hallazgos de imagen no fueron típicos, por lo que se considera que el paciente del caso mostró una variedad cutánea secundaria a la manifestación rinosinusal.
De acuerdo con la guía internacional para el diagnóstico y tratamiento de la mucormicosis, el tratamiento se basa en el desbridamiento quirúrgico con márgenes limpios, en busca del control de la enfermedad, estudio histopatológico y diagnóstico microbiológico, en conjunto con el tratamiento antifúngico y el control de las causas subyacentes. El tratamiento quirúrgico no siempre es posible en pacientes con inmunodepresión severa, críticamente enfermos o con afección en órganos profundos, como en la forma pulmonar o cerebral. Se recomienda como primera línea la anfotericina B liposomal a dosis de 5 mg/kg al día.1 En caso de contar únicamente con anfotericina B desoxicolato, la dosis convencional es de 0.25 a 0.75 mg/kg/día y de 1 a 1.5 mg/kg/día en casos graves.7 La tasa de mortalidad varía del 40 al 80%, con una supervivencia mayor en pacientes inmunocompetentes, con localización nasal o cutánea, y peor pronóstico en pacientes con neoplasias hematológicas, receptores de trasplante de células madre hematopoyéticas, quemaduras extensas, afección gastrointestinal y diseminación al sistema nervioso central, cuya tasa de mortalidad es de, incluso, el 80%.1 El retraso en el tratamiento quirúrgico y las enfermedades de base del paciente del caso fueron los condicionantes de su trágico desenlace, lo que resalta la importancia de un diagnóstico y tratamiento inmediatos ante la sospecha clínica.
El objetivo de este artículo fue comunicar un caso de mucormicosis rinosinusal con afección cutánea en un paciente con síndrome hemofagocítico secundario a mieloma múltiple, que raramente se complica con infecciones fúngicas, como mucormicosis o aspergilosis, pero se caracteriza por tener morbilidad y mortalidad altas.
REFERENCIAS
1. Cornely OA, Alastruey-Izquierdo A, Arenz D, et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium. Lancet Infect Dis 2019; 19 (12): e405-e421. https://doi.org.10.1016/S1473-3099(19)30312-3
2. Rose SR, Hamill RJ. Mucormicosis. En: Papadakis MA, Rabow MW, McQuaid KR. Diagnóstico clínico y tratamiento. 64ª ed. San Francisco: McGraw Hill Education, 2025.
3. Aqsa A, Droubi S, Glaser A. Aspergillus and Rhizopus fungal coinfection in a patient with multiple myeloma. Cureus 2020; 12 (5): e8050. https://doi.org.10.7759/cureus.8050
4. Bhattacharya D, Iyer R, Nallasamy K, et al. Haemophagocytic lymphohistiocytosis with pulmonary mucormycosis: fatal association. BMJ Case Reports 2019; 12 (5): e230587. https://doi.org.10.1136/bcr-2019-230587
5. Dien Bard J., Mangahis A, Hofstra TC, et al. First case report of bloodstream infection by Rhizomucor pusillus in a child with hemophagocytic lymphohistiocytosis. Medical Micology Case Reports 2014; 5: 20-23. https://doi.org.10.1016/j.mmcr.2014.05.002
6. Inagaki N, Sugimoto K, Hosone, et al. Disseminated Mucor infection and thrombotic microangiopathy in lymphoma-associated hemophagocytic syndrome. Int J Hematol 2008; 88: 355-356. https://doi.org.10.1007/s12185-008-0156-6
7. Bonifaz A. Micología Médica Básica. 6ª ed. McGraw-Hill, Interamericana, CDMX, México, 2020.
8. Bonifaz A, Barrón T, Collazo-Jaloma J. Zigomicosis (mucormicosis) cutánea en paciente con leucemia. Actas Dermo-Sifiliograficas 2002; 93 (8): 514-517. https://doi.org.10.1016/s0001-7310(02)76625-8
9. Arellano I. Saúl A. Lecciones de Dermatología. 17ª ed. CDMX: McGraw-Hill, México, 2024.
10. Skiada A, Drogari-Apiranthitou M, Pavleas I, et al. Global cutaneous mucormycosis: A systematic review. J Fungi 2022; 8: 194. https://doi.org.10.3390/ jof8020194
11. Bonifaz A, Tirado-Sánchez, et al. Mucormycosis at a tertiary-care center in Mexico. A 35-year retrospective study of 214 cases. Mycoses 2021; 64 (4): 372-380. https://doi.org.10.1111/myc.13222
12. Lanternier F, Dannaoui E, Morizot G, et al. A global analysis of mucormycosis in France: The RetroZygo study (2005-2007). Clin Infect Dis 2012; 54 Suppl 1: S35-43. https://doi.org.10.1093/cid/cir880
13. Longo DL. Hemophagocytic lymphohistiocytosis. N Engl J Med 2025; 392 (6): 584-98.
14. Tuna E, Márquez F, Aguayo A. Síndrome hemofagocítico. En: Aguayo A, Martínez D. Hematología en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. 2ª ed. Ciudad de México: Permanyer, 2020: 139-151.
15. Navarro DI, Barragán G, Bonifaz A, et al. Pulmonary mucormycosis in a patient with kidney transplant and uncontrolled haemoptysis. Rev Iberoam Micol 2017; 34 (4): 233-236. https://doi.org.10.1016/j.riam.2017.03.005
Recibido: junio 2025
Aceptado: junio 2025
Este artículo debe citarse como: Basurto-Hurtado MR, Menéndez-Zertuche SM, Clemente-Callejas ZL, Aguilar-Mena C, Bonifaz A. Mucormicosis cutánea ¿es frecuente como complicación de linfohistiocitosis hemofagocítica y mieloma múltiple? Dermatol Rev Mex 2025; 69 (5): 745-749.