Kerion in pregnancy treated with terbinafine.
Dermatol Rev Mex. 2024; 68 (1): 140-145. https://doi.org/10.24245/drm/bmu.v68i1.9489
Alejandro Eduardo De Aguinaga Inurriaga, Andrea Fernanda López Gutiérrez
Dermatólogos de práctica privada egresados del Hospital Civil de Guadalajara Fray Antonio Alcalde, Guadalajara, Jalisco, México.
ANTECEDENTES
La tiña de la cabeza es una dermatofitosis de la piel cabelluda ocasionada por hongos dermatofitos. El querión de Celso es una variedad inflamatoria de la tiña de la cabeza que es común en la infancia y la pubertad y muy poco común en pacientes adultos. Comunicamos el caso de una paciente de 23 años embarazada (tercer trimestre de la gestación) con diagnóstico clínico y microbiológico de querión de Celso y su subsecuente tratamiento con terbinafina oral durante el embarazo. A nuestro conocimiento, éste es el primer caso reportado de una paciente embarazada con querión de Celso.
CASO CLÍNICO
Paciente femenina de 23 años, embarazada, de bajo nivel socioeconómico, que acudió a consulta dermatológica, desconocía las semanas de gestación exactas (creía encontrarse en el tercer trimestre) y sin contar con antecedentes de ninguna cita de control prenatal durante el embarazo actual.
Inició dos meses previos con descamación en la piel cabelluda acompañada de prurito de predominio en el vértice, que progresó las semanas siguientes con pequeñas pústulas diseminadas con secreción de material purulento y aumento de volumen progresivo en esa región acompañado de dolor. Posteriormente se agregaron zonas de alopecia difusa, lo que la llevó a buscar atención médica.
En el examen clínico se encontró una dermatosis única, polimorfa, localizada en la región de la piel cabelluda de predominio en áreas temporales y occipitales, constituida por múltiples áreas alopécicas con placas de escamas amarillentas-blanquecinas sobre fondo eritematoso y algunas pústulas difusas de apariencia subaguda. En la región del vértice se observó edema de apariencia pseudotumorosa, con descamación en la zona y dolor a la palpación. Figura 1
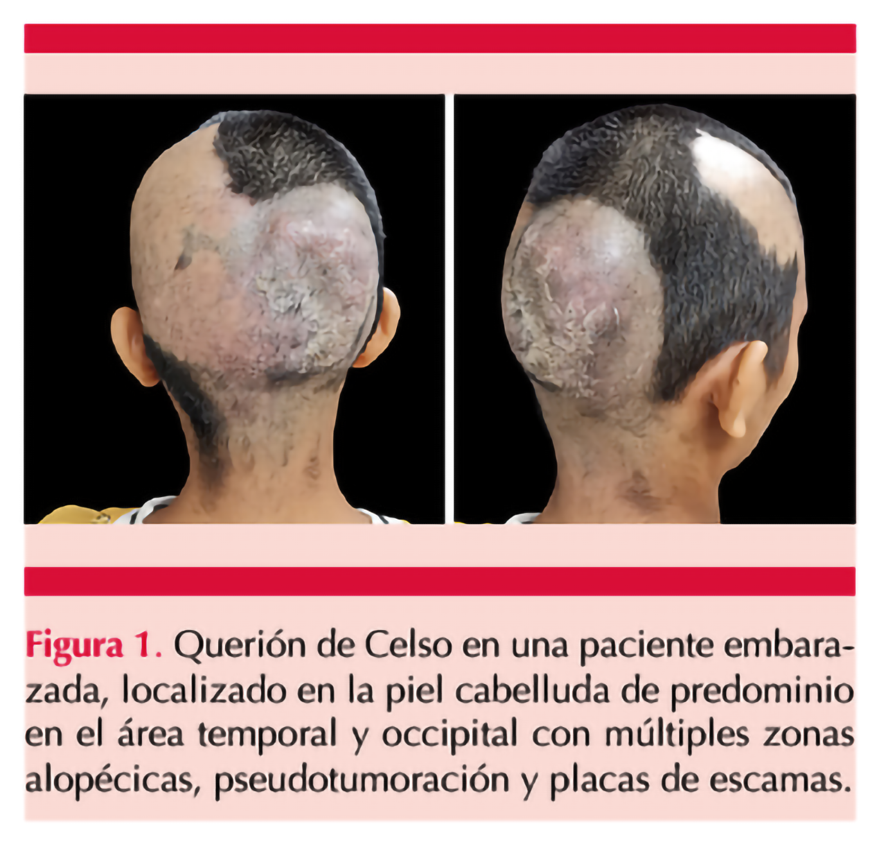
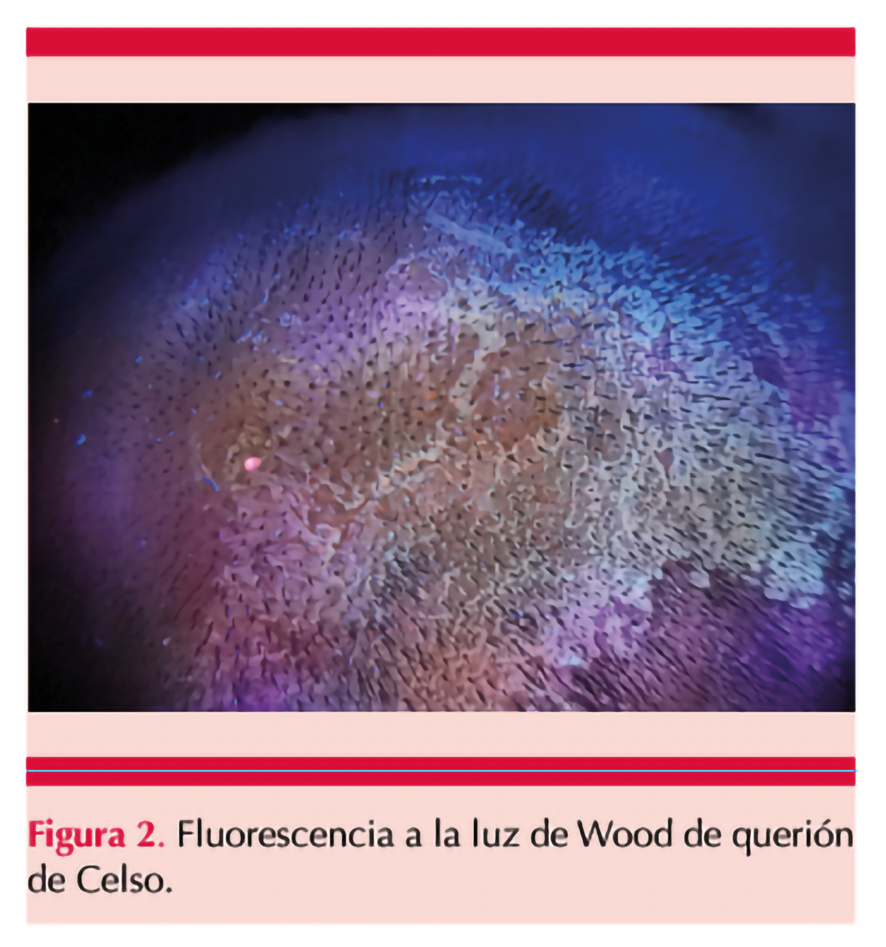
Ante la sospecha diagnóstica de querión de Celso se realizó estudio con luz de Wood durante la exploración física que evidenció fluorescencia amarillenta-verdosa (Figura 2). A la dermatoscopia se observaron pelos rotos o distróficos, pelos en coma y puntos negros en áreas alopécicas.
Empíricamente después de la toma de biopsia se inició tratamiento con terbinafina a dosis de 250 mg cada 24 horas vía oral y prednisona 50 mg en descenso cada semana de 5 mg hasta su suspensión.
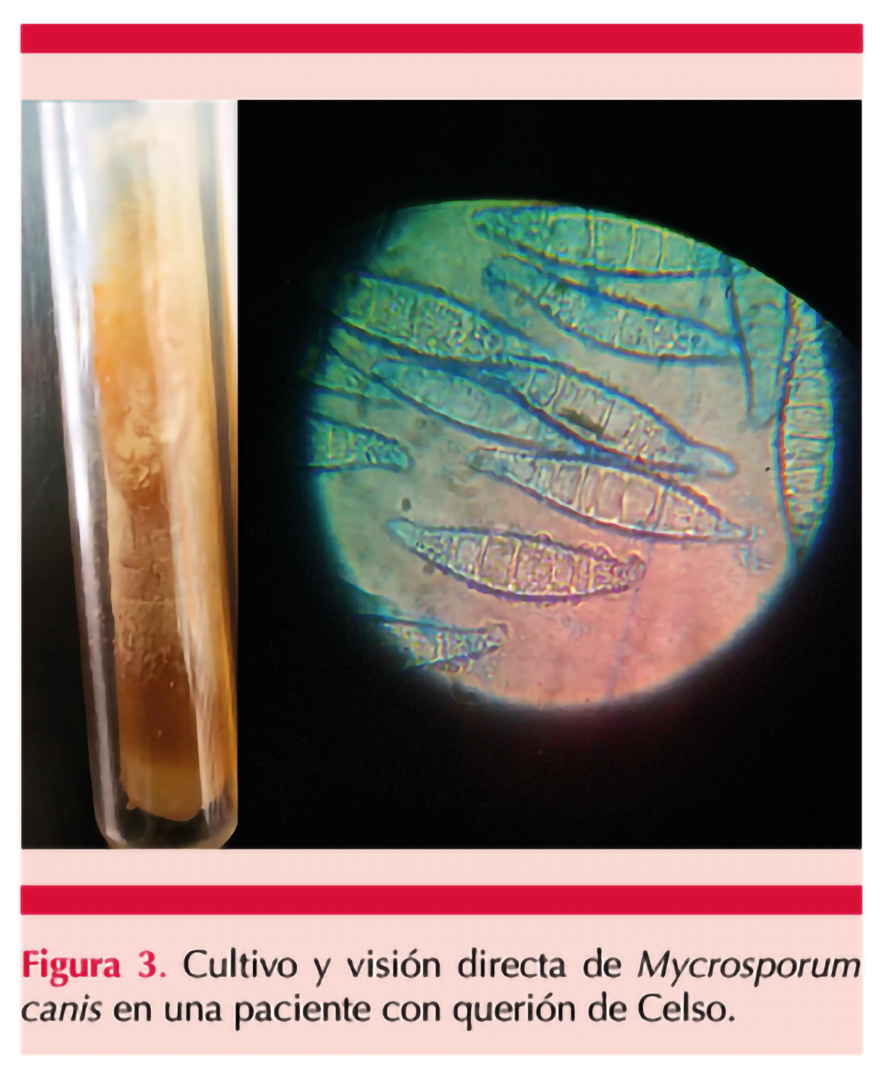
La muestra cutánea por histopatología sólo encontró datos de respuesta inflamatoria no diagnósticos para el caso. Sin embargo, semanas después se confirmó crecimiento de Microsporum canis en el cultivo y a la visión directa. Figura 3
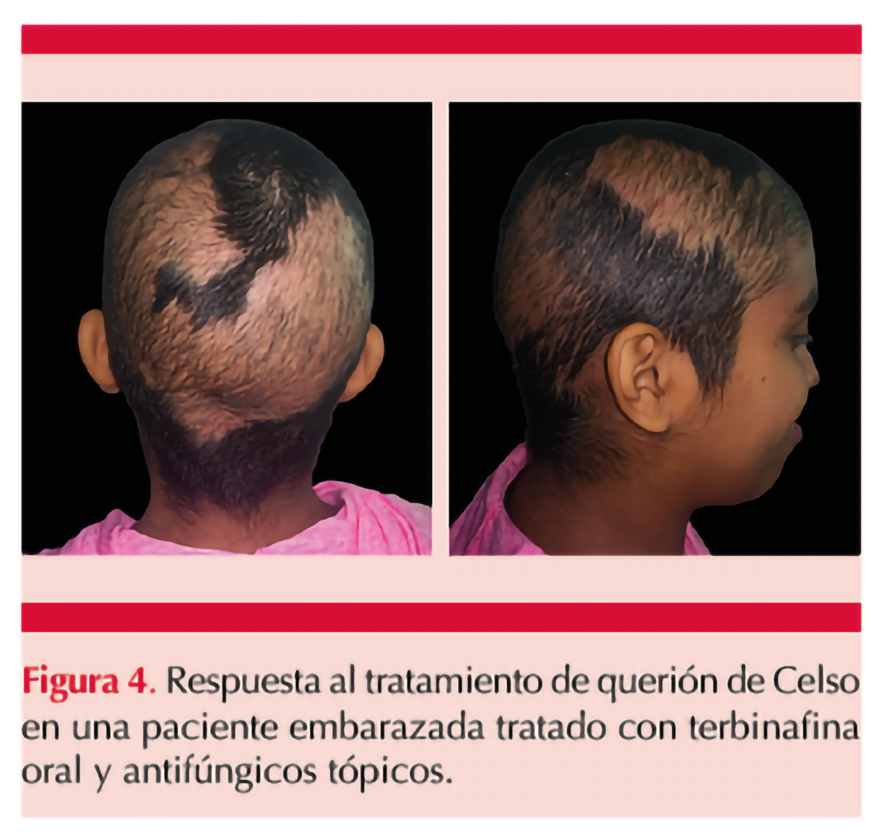
Una vez confirmado el agente etiológico, se siguió dando terbinafina 250 mg vía oral cada 24 horas en conjunto con champú de ketoconazol 3 veces por semana dejando reposar 3 a 5 minutos por un tiempo de 4 meses. La paciente respondió adecuadamente al tratamiento, lo cual se comprobó clínicamente en su cita de revisión a los dos meses posterior al inicio de los medicamentos con recuperación del pelo, disminución de la descamación y edema, al igual que inexistencia de pústulas. Figura 4
Durante el transcurso restante del tratamiento, la paciente se atendió en un hospital público debido a trabajo de parto sin detonantes aparentes; se obtuvo un neonato masculino, íntegro en estructuras físicas, sin complicaciones durante el parto, Apgar 8/10 y sin necesidad de unidad de cuidados intensivos o incubadora.
DISCUSIÓN
La tiña de la cabeza es una dermatofitosis de la piel cabelluda que se manifiesta clínicamente con eritema, áreas alopécicas que pueden o no volverse cicatriciales, prurito y descamación.1-6
En México la tiña de la cabeza ocupa el cuarto lugar de las micosis más frecuentes, con una frecuencia del 4 al 10%. En nuestro medio los principales agentes son M. canis (80%), T. tonsurans (15%) y otros dermatofitos (5%).5,6 Predomina la variedad seca en un 90%, por lo que sólo el 10% restante se manifiesta de forma inflamatoria. En el mundo el agente más común es Microsporum canis;2,3 sin embargo, en Estados Unidos y Reino Unido el principal agente etiológico es Trichophyton tonsurans.1-6 El querión de Celso representa la forma inflamatoria más grave de la tiña de la cabeza que resulta de una intensa respuesta inmunitaria a la infección. Los patógenos más comunes son hongos zoofílicos como Trichophyton mentagrophytes y T. verrucosum.1,2,7
La etapa de aparición más común es entre la infancia y la pubertad (97%). Posterior a estas edades es poco prevalente debido a que los cambios en el pH y secreción sebácea de los adolescentes producen un efecto fungistático en la piel cabelluda. Predomina en la población con nivel socioeconómico bajo, así como en pacientes con malos hábitos higiénicos y con mayor contacto con animales infectados.2-6 Los casos en adultos son excepcionales y en su mayoría están relacionados con factores como tiñas de la cabeza crónicas, padecimientos metabólicos, como la diabetes, y algunas deficiencias del sistema inmunológico.3
La tiña de la cabeza se adquiere a través del contacto directo de la piel cabelluda con el dermatofito causante, con una persona o animal infectado o con un objeto contaminado (por ejemplo: peine, cepillo o sombrero). El contacto con portadores asintomáticos de los organismos causales es un modo de transmisión adicional que puede desempeñar un papel importante en las recurrencias de la tiña de la cabeza y la tiña del cuerpo.8
La interacción entre el huésped y el patógeno comienza con la unión de los elementos fúngicos en el tallo del pelo y los queratinocitos. El tallo piloso y la piel cabelluda son penetrados por una activación de proteasas, glicoproteínas de manano en las paredes celulares de los dermatofitos y enzimas proteolíticas (como la queratinasa) que promueven la adherencia al tejido que contiene la queratina.2,4,9
Posterior a este primer contacto el huésped reacciona con una respuesta inmunitaria innata, ocasionando la producción de péptidos antimicrobianos y posteriormente inicia la respuesta inmunitaria mediada por células T del sistema inmunitario adquirido que implica la vía de señalización del receptor tipo lectina C, interleucina 17 e interferón γ (respuesta inmunitaria Th17).2
M. canis, al activar los genes de subtilisina SUB1, SUB2 y SUB3, libera proteasas que permiten la infiltración del cabello, lo cual origina una respuesta inmunológica de hipersensibilidad en el huésped. Además, se activa el gen de la fungalisina MEP3 que codifica las metaloproteasas. Estos son factores de virulencia del hongo.2,3
La tiña de la cabeza puede clasificarse según su invasión como endótrix (con las variantes tricofítica y fávica) y el tipo ecto-endótrix (con 3 variedades).6 Existen dos formas inflamatorias que son clínicamente indistinguibles entre ellas; la más común es el querión de Celso (una reacción de hipersensibilidad mediada por inmunidad celular) y la menos común es el granuloma de Majocchi en la cabeza, una dermatofitosis profunda que se manifiesta generalmente en pacientes con trastornos inmunológicos (típicamente afecta las extremidades inferiores).3,5
El querión de Celso inicia con una o varias placas pseudoalopécicas sobre una base de escamas difusas fácilmente confundidas con dermatitis seborreica, eritema, pústulas y costras melicéricas; éstas, a su vez, generan una respuesta inflamatoria con aumento de volumen con contenido de material purulento en aspecto de panal de abejas, donde el síntoma principal es el dolor en el sitio. En los casos en los que llega a progresar genera fibrosis y alopecia cicatricial con adenopatías regionales dolorosas a la palpación y afectación al estado general.5,6,7
Las dermatofitosis son comunes en el embarazo debido a varios factores: el estado de tolerancia inmunológica de la madre, el incremento de peso y de sudoración.10 Respecto al sistema inmunológico, en pacientes embarazadas podemos encontrar disminución de la reactividad a pruebas cutáneas, quimiotaxis defectuosa de células fagocíticas y alteración de la respuesta blastogénica linfocítica.11 A pesar de estos factores de riesgo de dermatofitosis, no existen muchos reportes de dermatofitosis de tipo inflamatorio en pacientes embarazadas. En una búsqueda realizada en PubMed sin filtros para fechas de publicación de los términos “granuloma de Majocchi/querión de Celso” + “embarazo/embarazada” en inglés y en español localizaron sólo un caso previamente reportado de una paciente embarazada con diagnóstico de granuloma de Majocchi en el tercer trimestre.11 A nuestro conocimiento, éste es el primer caso reportado de una paciente embarazada con querión de Celso.
El diagnóstico es clínico y microscópico con preparaciones de KOH y confirmado por cultivo o diagnóstico molecular.2,5 La luz de Wood ha demostrado utilidad de hasta el 55.7% de los casos en pacientes mexicanos con tiña de la cabeza, lo que demuestra la importancia de identificar el microorganismo implicado por medio de la fluorescencia amarilla-verdosa emitida por esta luz en infecciones ecto-endótrix o por M. canis, y excluir las infecciones en tipo endótrix o tiñas tricofíticas por T. tonsurans.3,5
El examen directo es una prueba micológica con alta sensibilidad para el diagnóstico; sin embargo, podría resultar un poco confuso en los casos de tiñas inflamatorias debido a que la misma inflamación dificulta la toma adecuada de pelos parasitados. En esos casos se recomienda obtener material purulento con restos celulares para utilizarlos en cultivos.3
La dermatoscopia es útil en el diagnóstico y complementa el estudio micológico. Los pelos en forma de coma son un marcador de infecciones micóticas. También es posible encontrar pelos en código de barras, que son pelos interrumpidos de forma irregular. Otros datos inespecíficos, pero que complementan el diagnóstico son pelos distróficos, en sacacorchos, en zigzag o puntos negros y pelos rotos.5
El diagnóstico erróneo más común del querión de Celso es una infección bacteriana de la piel cabelluda, sobre todo en pacientes adultos en los que ya no es común encontrar infecciones por hongos en piel cabelluda. Algunos otros diagnósticos diferenciales pueden ser la foliculitis crónica, como foliculitis decalvante o la foliculitis/pseudofoliculitis abscesiforme de la piel cabelluda, los cuales son diagnósticos con probabilidad de aparición en adultos mucho mayor. Asimismo, es importante tener en cuenta otros diagnósticos, como alopecia areata, liquen plano pilar, sífilis secundaria, tricotilomanía, morfea y lupus eritematoso discoide crónico.2
El tratamiento debe incluir siempre antimicóticos sistémicos para evitar o al menos limitar la alopecia cicatricial lo más posible y debe iniciarse inmediatamente una vez establecido el diagnóstico. El tratamiento tópico como monoterapia generalmente no se recomienda debido a que las preparaciones de este tipo no alcanzan a penetrar la vaina del pelo (a excepción únicamente en lactantes y en infecciones de corta evolución).2,6
Se debe considerar la administración de corticosteroides como la prednisona a dosis de 0.3-1 mg/kg al día durante una a dos semanas con el propósito de disminuir la respuesta inflamatoria y evitar la alopecia cicatricial.2,5,6
La griseofulvina logra tasas de eliminación micológica más altas que la terbinafina en las infecciones infantiles por M. canis. Se recomienda una dosis ponderal de 10-20 mg/kg al día durante 8 a 12 semanas. Se reporta una tasa de curación del 96%. Los efectos adversos incluyen náuseas y erupciones exantemáticas en el 8 al 15%. Está contraindicada en el embarazo. La dificultad del tratamiento con este medicamento en México es la escasez de existencia comercial, lo que la vuelve un medicamento difícil de encontrar.5,6
La terbinafina se sugiere en casos de mala respuesta o resistencia al tratamiento, sobre todo en niños mayores de 3 años, en los que la terbinafina ha mostrado tasas de curación del 88%. La dosis recomendada es de 3-6 mg/kg al día durante 4 a 6 semanas. Los efectos adversos asociados son alteraciones gastrointestinales y erupciones en el 3 al 5% de los casos. En el embarazo tiene clasificación B, por lo que se sugiere prescribirla sólo en caso muy necesario.5,6
El itraconazol es otro de los medicamentos posibles, se recomienda a una dosis ponderal de 3-6 mg/kg al día durante 4 a 6 semanas con una dosis máxima de 400 mg. Se ha demostrado una eficacia similar entre ciclos de 6 semanas de itraconazol y griseofulvina para tratar infecciones por M. canis. Los posibles efectos secundarios del itraconazol incluyen malestar gastrointestinal, erupciones cutáneas, dolor de cabeza, somnolencia, mareos y anomalías en las pruebas de función hepática. Las pruebas de función hepática están indicadas antes del tratamiento en pacientes con disfunción hepática preexistente.6,12
De forma adicional se indica champú con ketoconazol al 2%, disulfuro de selenio y piritionato de cinc. Se recomienda su administración al menos dos veces por semana para disminuir la eliminación de esporas fúngicas.5,13
El diagnóstico de dermatofitosis inflamatoria en una paciente embarazada es una situación especialmente desafiante para el médico tratante, debido a que los tratamientos de primera línea suelen ser medicamentos no aprobados para su administración en pacientes embarazadas. En estos casos, suele elegirse terbinafina por ser un medicamento categoría B en el embarazo, debido a que la griseofulvina y los azoles orales están completamente contraindicados por su potencial teratogénico.14 Elston y Elston sugieren evitar la terbinafina durante el primer y segundo trimestres del embarazo debido a la falta de estudios en esta categoría de pacientes y, en caso de indicarla, sugieren realizar ultrasonografía detallada del feto.14 Por su parte, Andersson y su grupo no encontraron asociación con parto pretérmino, disminución del peso para la edad gestacional u óbito en pacientes expuestas a terbinafina durante el embarazo,15 habiendo realizado previamente otro estudio en el que concluyeron que la terbinafina oral o tópica no se asociaba con riesgo incrementado de malformaciones o aborto espontáneo.16
CONCLUSIONES
A pesar de que la tiña de la cabeza es de predominio en niños y jóvenes, es importante recordar que uno de sus factores de riesgo más importantes es un estado de inmunosupresión basal. El embarazo propicia una respuesta de tipo Th2, volviendo más favorable la infección por esta clase de organismos. Este caso es de importancia debido a que no existen los suficientes reportes de casos de tiña inflamatoria en el embarazo, así como con manejo complicado debido a que los fármacos que se requieren para tratar los agentes etiológicos del querión de Celso no son de recomendación durante el embarazo. Por estos motivos, es importante incrementar el conocimiento respecto a esta enfermedad y su posibilidad de manifestación atípica para facilitar el diagnóstico, logrando un tratamiento oportuno con efecto benéfico y recuperación sin complicaciones en la paciente durante el embarazo.
REFERENCIAS
1. Mirmirani P, Tucker LY. Epidemiologic trends in pediatric tinea capitis: a population-based study from Kaiser Permanente Northern California. J Am Acad Dermatol 2013; 69 (6): 916-21. DOI: 10.1016/j.jaad.2013.08.031.
2. Chiriac A, Birsan C, Mares M, Wollina U. Kerion Celsi durch Microsporum canis [Kerion Celsi due to Microsporum canis infection]. Hautarzt 2021; 72 (10): 855-859. DOI: 10.1007/s00105-021-04817-1.
3. Martinez H, Guevara N, Mena C, Valencia A, Araiza J, Bonifaz A. Tiña de la cabeza. Reporte de 122 casos. Dermatologia CMQ 2007; 5 (1): 9-14.
4. Zuluaga A, Cáceres D, Arango K, Bedout C, Cano L. Epidemiología de la tinea capitis: 19 años de experiencia en un laboratorio clínico especializado en Colombia. Infectio 2016; 20 (4): 225-230. DOI: 10.1016/j.infect.2015.11.004.
5. Padilla M, Villanueva A, Maza C, Rosas M. Querión de Celso por Trichophyton mentagrophytes. Comunicación de un caso. Rev Cent Dermatol Pascua 2017; 26: 49-53.
6. Rebollo N, López A, Arenas R. Tiña de la cabeza. Actas Dermosifiliogr 2008; 99: 91-100. DOI: 10.1016/S0001-7310(08)74630-1.
7. Isa-Isa R, Arenas R, Isa M. Clin Dermatol 2010; 28 (2): 133-6. DOI: 10.1016/j.clindermatol.2009.12.013.
8. Kawachi Y, Ikegami M, Takase T, Otsuka F. Pediatr Dermatol 2010; 27 (5): 527-8. 10.1111/j.1525-1470.2010.01270.x.
9. Nenoff P, Krüger C, Ginter-Hanselmayer G, Tietz HJ. J Dtsch Dermatol Ges 2014; 12 (3): 188-209. DOI: 10.1111/ddg.12245.
10. Prabhu S, Sankineni P. Managing dermatophytoses in pregnancy, lactation, and children. Clin Dermatol Rev 2017; 1: S34-S37. DOI: 10.4103/CDR.CDR_29_17.
11. Wang R, Hu Y, Tang H, Zhang T. Majocchi granuloma in a pregnant woman. Obstet Gynecol 2014; 124: 423-425. DOI: 10.1097/AOG.0000000000000302.
12. López S, Del Palacio A, Van Cutsem J, Soledad Cuétara M, Iglesias L, Rodriguez A. Int J Dermatol 1994; 33 (10): 743-7. DOI: 10.1111/j.1365-4362.1994.tb01525.x.
13. Chen C, Koch LH, Dice JE, Dempsey KK, Moskowitz AB, Barnes-Eley ML, Hubbard TW, Williams JV. Pediatr Dermatol 2010; 27 (5): 459-62. DOI: 10.1111/j.1525-1470.2010.01093.x.
14. Elston CA, Elston DM. Treatment of common skin infections and infestations during pregnancy. Dermatol Ther 2013; 26 (4): 312-20. doi: 10.1111/dth.12075.
15. Andersson NW, Thomsen SF, Andersen JT. Exposure to terbinafine in pregnancy and risk of preterm birth, small for gestational age, low birth weight, and stillbirth: A nationwide cohort study. J Am Acad Dermatol 2021; 84 (3): 763-767. doi: 10.1016/j.jaad.2020.10.034.
16. Andersson NW, Thomsen SF, Andersen JT. Evaluation of association between oral and topical terbinafine use in pregnancy and risk of major malformations and spontaneous abortion. JAMA Dermatol 2020; 156 (4): 375-383. doi: 10.1001/jamadermatol.2020.0142.
Recibido: mayo 2023
Aceptado: junio 2023
Este artículo debe citarse como: De Aguinaga-Inurriaga AE, López-Gutiérrez AF. Querión de Celso en el embarazo tratado con terbinafina. Dermatol Rev Mex 2024; 68 (1): 140-145.

