Bullous penfigoid associated with COVID-19 vaccine.
Dermatol Rev Mex. 2021; 65 (6): 1014-1016. https://doi.org/10.24245/dermatolrevmex.v65i6.7178
Laura Leticia Pérez-Corrales,1 Norma Lizeth Flores-Madrigal,2 Marisela Valencia-Álvarez,4 América Serrano-González,3 David Arturo López-Martínez5
1 Residente de segundo año de la especialidad de Medicina Interna.
2 Dermatólogo adscrito al servicio de Dermatología.
3 Infectólogo e internista.
Hospital General Regional núm. 20, IMSS, Tijuana, Baja California, México.
4 Dermatólogo especialista en Dermatopatología. Práctica privada. Tijuana, Baja California, México.
5 Médico pasante del Servicio Social, Cruz Roja Mexicana, Tijuana, Baja California, México.
ANTECEDENTES
El penfigoide ampolloso es una enfermedad subepitelial adquirida y autoinmunitaria caracterizada por ampollas subepidérmicas intensas e inmunofluorescencia positiva con IgG lineal y C3 en la membrana basal. Es la enfermedad ampollosa más común y su incidencia ha ido aumentando gradualmente.1,2 Entre los posibles factores desencadenantes se asocian la inmunización y las infecciones virales. Se han informado algunos casos de penfigoide ampolloso poco después de la administración de vacunas (tétanos, difteria, tos ferina, polio, rabia, hepatitis B, rotavirus, neumococo o gripe), aunque el mecanismo inmunológico subyacente aún no está claro.3,4 Comunicamos el caso de un hombre que manifestó penfigoide ampolloso tras recibir la primera dosis de BNT162b2 (RNAm, Pfizer-BioNTech).
CASO CLÍNICO
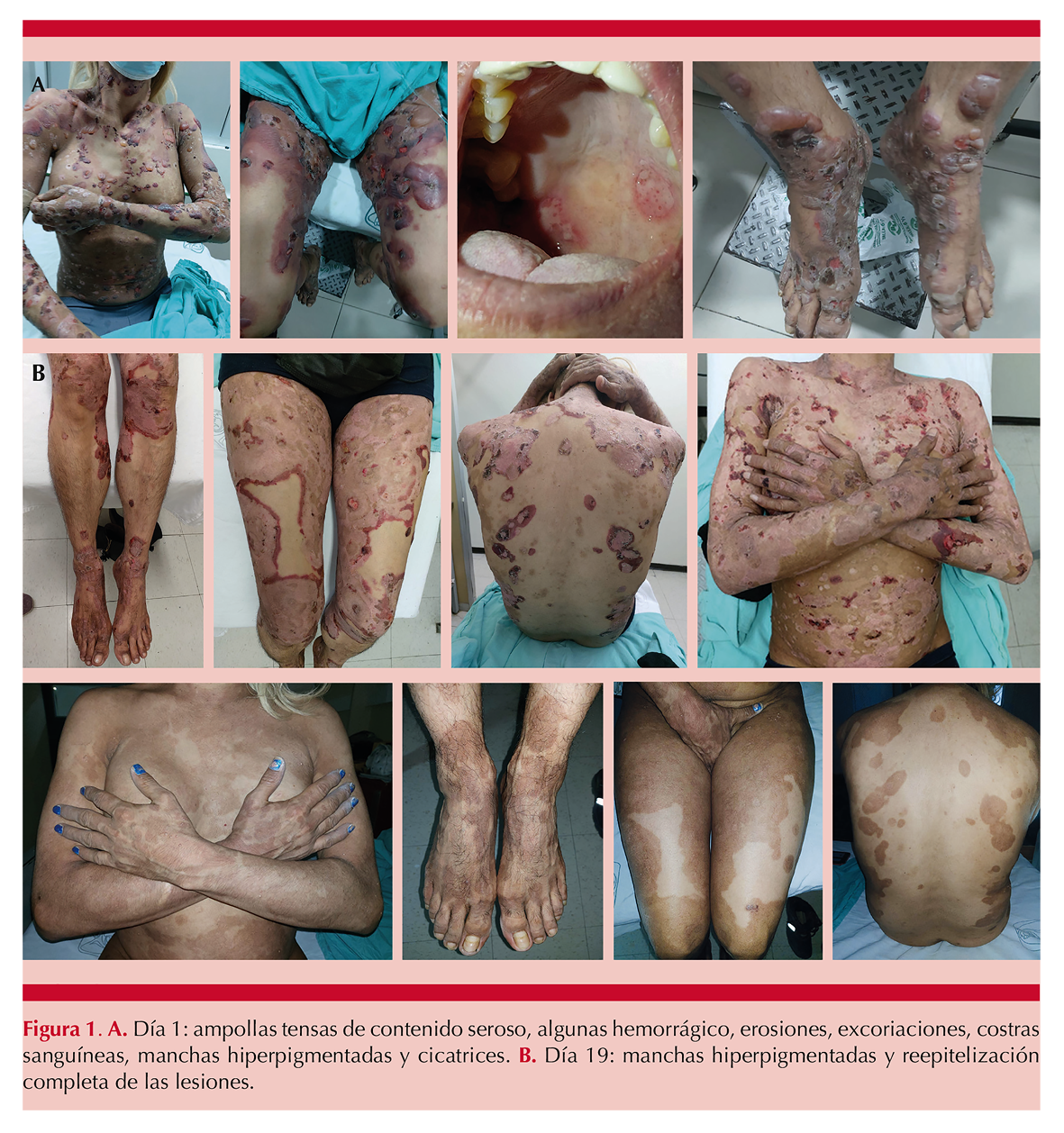
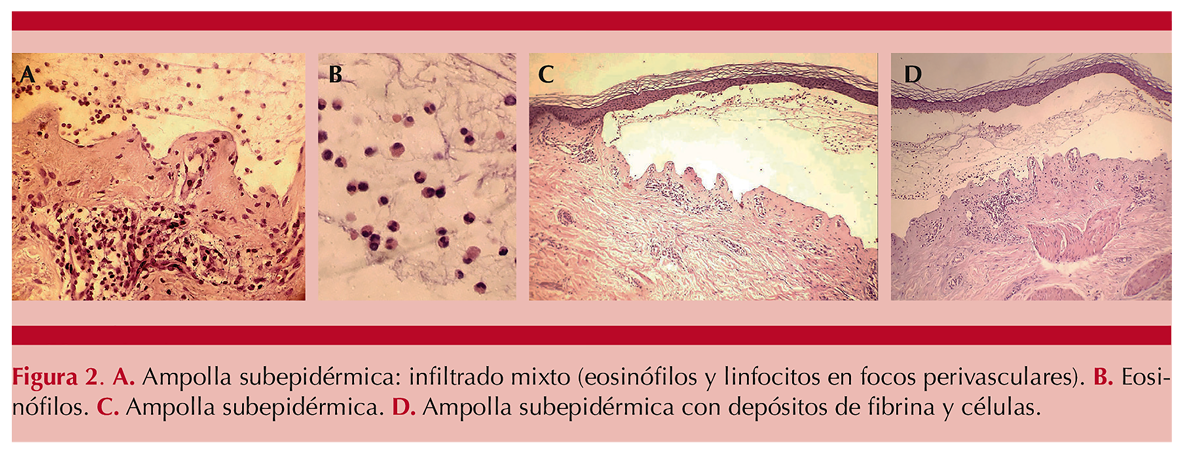
Paciente masculino de 53 años de edad ingresado a hospitalización el día 11 de junio de 2021 por padecer una dermatosis ampollosa generalizada (Figura 1A) que manifestó posterior a la aplicación de vacuna BNT162b2 contra el virus SARS-CoV-2 el día 18 de mayo de 2021; se corroboró el diagnóstico de penfigoide ampolloso (Figura 2). El paciente fue manejado con corticosteroide vía oral (prednisona 1 mg/kg al día) y antihistamínico de primera generación, así como fomentos con polvo coloide, sulfadiazina de plata y apósitos con gasa parafinada en lesiones activas. Durante su hospitalización se indicaron inmunomoduladores (azatioprina 1.8 mg/kg al día –dosis inicial–, 2.7 mg/kg al día –dosis de mantenimiento– y talidomida 1 mg/kg al día), con lo que tuvo evolución clínica favorable. Al día 12 de hospitalización se administró tratamiento con IgIV a dosis de 1.5 g/kg/dosis y posteriormente fue dado de alta con reepitelización completa de las lesiones y remisión de la enfermedad (Figura 1B).
La vacunación se ha relacionado con fenómenos autoinmunitarios, como la aparición de anticuerpos de ADN, trastornos localizados, como la artritis reactiva y enfermedades sistémicas. Probablemente la activación de la cascada inflamatoria causada por la inyección de la vacuna activa las células Th17 con aumento de IL-17 que es capaz de liberar citocinas proinflamatorias, enzimas proteolíticas y reclutar y activar neutrófilos que, por sí mismos, pueden resultar en la formación de ampollas.5 Pérez-López y su grupo publicaron recientemente un caso de penfigoide ampolloso en una mujer de 78 años que manifestó lesiones ampollosas tensas sobre una base eritematosa en la zona facial, el tronco y las extremidades tres días después de la aplicación de la vacuna COMIRNATY (RNAm, Pfizer-BioNTech), tratada con corticosteroides tópicos de alta potencia con lo que mostró estabilización del cuadro clínico. Tuvo reactivación de las lesiones después de la segunda dosis de la vacuna COMINARTY por lo que requirió tratamiento nuevamente. El mecanismo por el que la vacuna induce el penfigoide ampolloso no se conoce bien y es poco probable que una vacuna en sí misma explique tal asociación porque no existen similitudes entre la estructura vacunal y los antígenos de la membrana basal. Una hipótesis que se ha planteado con anterioridad es que la vacunación pueda desencadenar una mayor respuesta autoinmunitaria en pacientes con predisposición inmunológica relevante.3
Nuestro paciente manifestó las lesiones características de penfigoide ampolloso en las primeras horas posteriores a la administración de la primera dosis de la vacuna contra COVID-19, BNT162b2, seguido de un periodo de empeoramiento progresivo clínico en la segunda semana, por lo que requirió hospitalización durante 12 días para iniciar terapia inmunológica y fue dado de alta tras mostrar remisión de las lesiones. La relación temporal con la primera administración apoya la hipótesis de una posible relación entre la vacuna administrada BNT162b2 y la aparición del penfigoide ampolloso en nuestro paciente presentando en el algoritmo de causalidad de Naranjo una puntuación de 5 (reacción causal probable).
REFERENCIAS
1. Walmsley N, Hampton PJ. Bullous pemphigoid triggered by swine flu vaccination: case report and review of vaccine triggered pemphigoid. J Dermatol Case Rep 2011; 5: 4. http://dx.doi.org/10.3315/jdcr.2011.1081.
2. Yayla D, Hizli P, Yayla Y. Bullous pemphigoid. Autoimmune Bullous Diseases http://dx.doi.org/10.5772/intechopen.73543.
3. Pérez-López I, Moyano-Bueno D, Ruiz-Villaverde R. Penfigoide ampolloso y vacuna COVID-19. Medicina Clínica 2021. https://doi.org/10.1016/j.medcli.2021.05.005.
4. Baroero L, Coppo P, Bertolino L, Maccario S, et al. Three case reports of post immunization and post viral bullous pemphigoid: looking for the right trigger. BMC Pediatrics 2017; 17 (1). https://doi.org/10.1186/s12887-017-0813-0.
5. Neri I, Greco A, Bassi A, Orgaz-Molina J, et al. Bullous pemphigoid in infant post vaccination: Myth or reality? Int J Immunopathol Pharmacol 2015; 29 (2): 295-299. DOI: 10.1177/0394632015603796.
Recibido: octubre 2021
Aceptado: noviembre 2021
Este artículo debe citarse como: Pérez-Corrales LL, Flores-Madrigal NE, Valencia-Álvarez M, Serrano-González A, López-Martínez DA. Penfigoide ampolloso asociado con vacuna contra COVID-19. Dermatol Rev Mex 2021; 65 (6): 1014-1016.