Nivolumab associated bullous pemphigoid: A diagnostic challenge in a patient with melanoma.
Dermatol Rev Mex. 2023; 67 (3): 456-459. https://doi.org/10.24245/drm/bmu.v67i3.8865
Ricardo Flaminio Rojas-López,1 Laura Isabel López-Molinares,2 Evy Leinad Reyes-Rivero3
1 Dermatólogo, Universidad Nacional, Bogotá, Colombia.
2 Médica general, Universidad Libre Seccional Barranquilla, Colombia.
3 Dermatóloga, Universidad Autónoma de Bucaramanga, Colombia.
ANTECEDENTES
El nivolumab es un anticuerpo monoclonal que actúa sobre el receptor de la proteína de muerte celular programada 1 (PD-1), aprobado inicialmente en 2014 por la FDA para el tratamiento de melanoma metastásico debido a su efecto antitumoral.1 Actualmente, se prescribe en el tratamiento del linfoma de Hodgkin, cáncer de pulmón de células no pequeñas y carcinoma de células renales.1,2
Este medicamento se ha asociado con ciertos eventos adversos relacionados con el sistema inmunitario, la toxicidad dermatológica es una de las descritas con más frecuencia en pacientes tratados con los inhibidores de PD-1.3 Entre las complicaciones cutáneas, está el penfigoide ampolloso, una dermatosis ampollar poco habitual pero cada vez más documentada en la bibliografía.4 Es fundamental el reconocimiento temprano de esta reacción adversa, la suspensión del agente causal y el abordaje terapéutico oportuno.
CASO CLÍNICO
Paciente masculino de 79 años, con antecedentes de hipotiroidismo, diagnosticado con melanoma en estadio avanzado en el pabellón auricular izquierdo, quien recibió tratamiento con cirugía de Mohs, vaciamiento ganglionar y terapia con nivolumab por oncología; sin embargo, durante la dosis número 24 de 30 propuestas de anti PD-1 tuvo un efecto adverso cutáneo. Acudió a consulta de dermatología por padecer prurito y lesiones cutáneas generalizadas de seis meses de evolución, sin respuesta terapéutica a betametasona tópica y dicloxacilina.
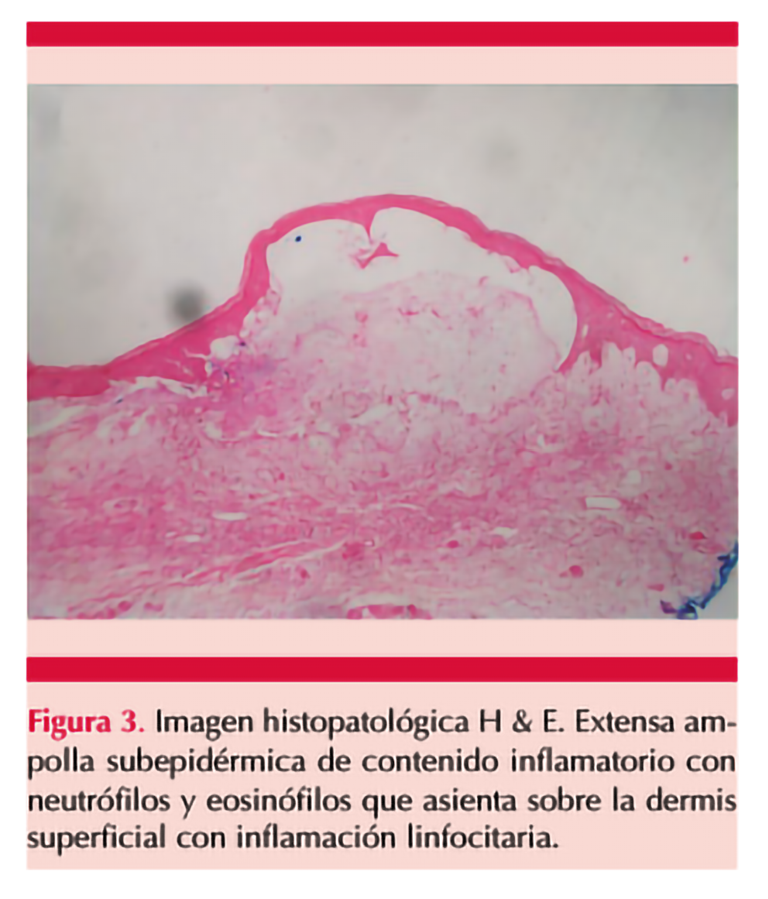
Al examen físico, se observaban placas eritematosas con ampollas tensas de contenido seroso, algunas esfaceladas, con exudado seroso y áreas costrosas en la región torácica, dorso-lumbar, los flancos y las extremidades (Figuras 1 y 2); sin afectación de las mucosas. La biopsia de piel evidenció una ampolla subepidérmica con infiltración de neutrófilos, eosinófilos e inflamación linfocitaria en la dermis papilar (Figura 3). La inmunofluorescencia directa mostró depósitos lineales de IgG en la unión dermoepidérmica. Se estableció el diagnóstico de penfigoide ampolloso inducido por nivolumab.
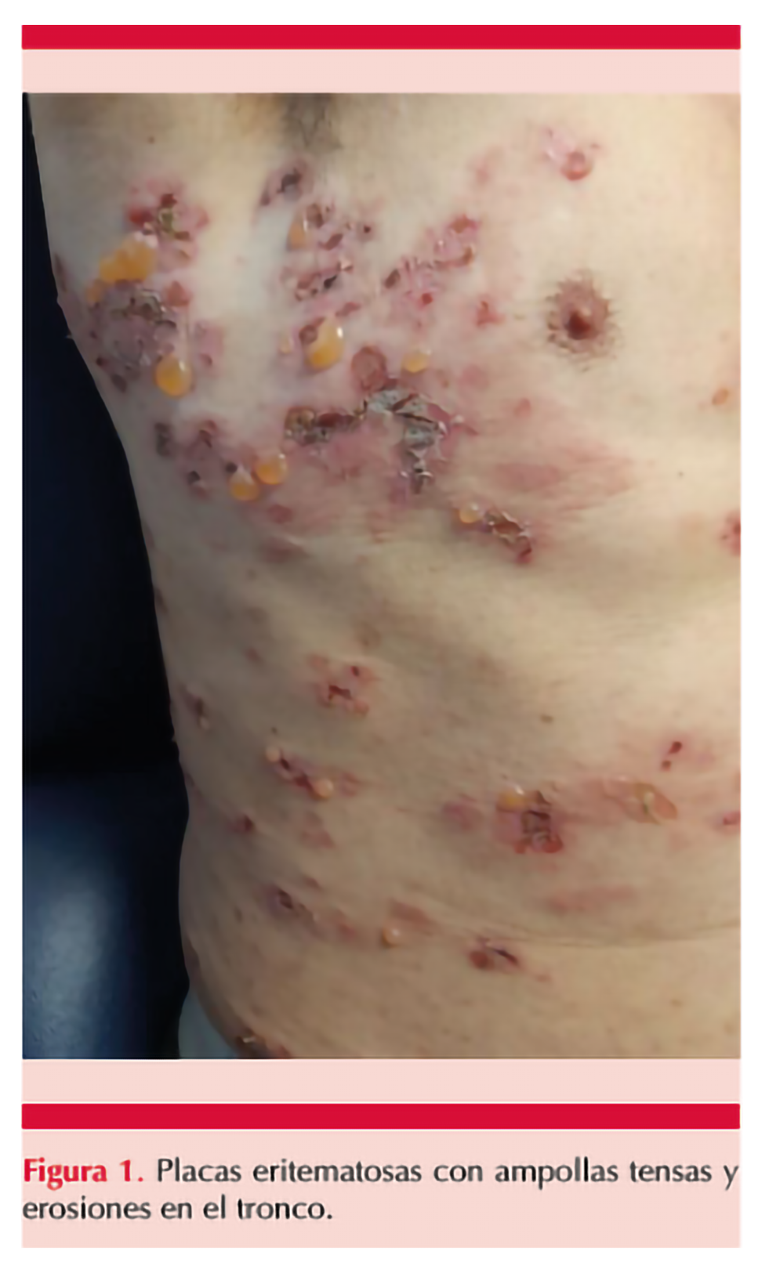
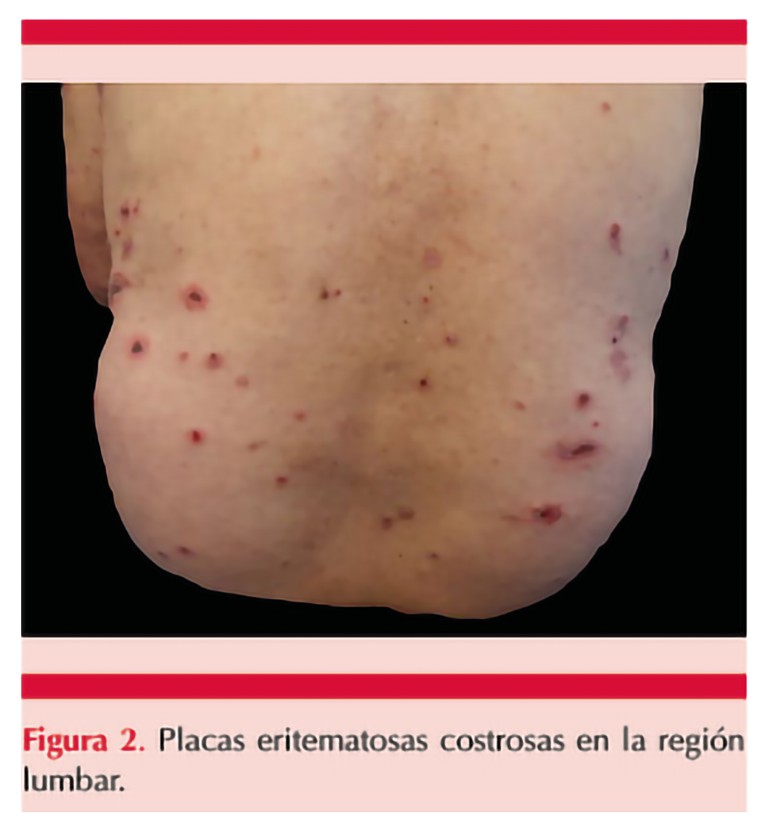
El paciente fue tratado con clobetasol, baños de acetato de aluminio, cetirizina y prednisolona oral con alivio completo de las lesiones ampollosas al mes de iniciar el tratamiento. Se remitió al servicio de oncología sugiriendo suspender la inmunoterapia, se continuó con tacrolimus ungüento, clobetasol en emulsión y prednisolona en dosis descendente, sin mostrar nuevas recaídas hasta la última valoración.
DISCUSIÓN
La inmunoterapia utiliza anticuerpos monoclonales, como el nivolumab, inhibidor de punto de control inmunitario que funciona contra los receptores de la proteína de muerte celular programada 1 (PD-1).2 Este agente actúa evitando el crecimiento tumoral y potenciando la respuesta de los linfocitos T hacia las células tumorales que expresan el ligando (PD-L1), por lo que se considera una opción terapéutica contra múltiples neoplasias malignas.5,6
Este fármaco causa diferentes eventos adversos relacionados con el sistema inmunitario que incluyen colitis, dermatitis, hepatitis, hipofisitis y neumonitis. Aproximadamente del 30 al 40% de los casos son manifestaciones cutáneas que incluyen prurito, exantema maculopapular y vitíligo. Alrededor del 1% de los pacientes tratados padecen dermatosis ampollosas, como el penfigoide ampolloso, dermatitis liquenoide ampollosa y dermatosis lineal por IgA.5,7,8
El penfigoide ampolloso es una enfermedad autoinmunitaria crónica, en la que hay una separación de la epidermis y la dermis generando un espacio ocupado por líquido, formando así una ampolla subepidérmica.2 El mecanismo fisiopatológico del penfigoide ampolloso inducido por nivolumab no se conoce con exactitud. Se plantea la hipótesis de que este medicamento podría alterar la regulación de células T y provocar una estimulación excesiva de células B, con el aumento de la producción de los autoanticuerpos contra el antígeno BP180. Esta proteína también está presente en la superficie de las células tumorales del melanoma maligno, carcinoma de células escamosas de la piel y cáncer de pulmón de células no pequeñas.5,6,9
Las lesiones cutáneas se caracterizan por ser heterogéneas con una primera fase de prurito generalizado, que en algunos casos representan el único síntoma inicial.3 Posteriormente, aparecen vesículas, ampollas tensas de contenido claro o hemático en el tronco y las extremidades, aunque en raras ocasiones también afecta las mucosas.10,11 Se ha descrito en series de casos que los síntomas se manifiestan durante seis a ocho meses después del inicio de la terapia con nivolumab.8
Varios autores sugieren que en los pacientes tratados con inhibidores de PD-1 que tienen prurito intratable es necesario realizar una biopsia de la piel considerando posible penfigoide ampolloso.5,9 El diagnóstico se establece mediante histopatología que muestra una ampolla subepidérmica con infiltrado de células inflamatorias de neutrófilos, eosinófilos y linfocitos en la dermis papilar. La inmunofluorescencia directa revela depósitos lineales de IgG, C3 o ambos en la unión dermoepidérmica, mientras tanto, en el estudio serológico existe elevación de autoanticuerpos contra los antígenos epiteliales implicados.12,13
De acuerdo con los eventos adversos cutáneos inducidos por la inmunoterapia, existe una clasificación del Instituto Nacional del Cáncer que guía el tratamiento de acuerdo con el porcentaje de superficie corporal afectada, desde grado 1 hasta el más grave, que es grado 4 (Cuadro 1).7 El grado 1 se beneficia de corticosteroides tópicos de alta potencia, mientras que los grados 2-4 requieren la administración de prednisolona, metilprednisolona o ambas vía intravenosa a dosis altas con la interrupción permanente de la inmunoterapia. Existen otros fármacos que se han prescrito con éxito como agentes ahorradores de esteroides como la doxiciclina, niacinamida, omalizumab, rituximab, dapsona, metotrexato, al igual que la plasmaféresis.7,14

CONCLUSIONES
Es importante que dermatólogos y oncólogos en conjunto realicen la detección temprana de los eventos adversos cutáneos relacionados con el nivolumab, entre los que se encuentra el penfigoide ampolloso como una afección poco frecuente, facilitando el diagnóstico oportuno y el adecuado abordaje terapéutico que contribuiría a disminuir la interrupción innecesaria de la inmunoterapia en pacientes afectados con cáncer y permitir una respuesta continua a los agentes anti-PD-1.
REFERENCIAS
1. Aggarwal P. Disproportionality analysis of bullous pemphigoid adverse events with PD-1 inhibitors in the FDA adverse event reporting system. Expert Opin Drug Saf 2019; 18 (7): 623-633.doi:10.1080/14740338.2019.1619693.
2. Lopes D, Andrade L, Rodrigues D, Pinheiro N, Olivieri A, Castro Garcia L. Bullous pemphigoid associated with the use of nivolumab in a patient with metastatic melanoma: a case report. Braz J Oncol 2020; 16: e-20200004. doi 10.5935/2526-8732.20200004.
3. Fernández L, Estébanez A, Pinazo I, Monteagudo C. Penfigoide ampollar en paciente en tratamiento con nivolumab. Piel 2021; 36 (4): 224- 226. doi:10.1016/j.piel.2020.04.018.
4. Schwartzman G, Simpson MM, Jones R, Schiavone K, Coffman M, Meyerle J. Anti-PD1 immune checkpoint inhibitor-induced bullous pemphigoid in metastatic melanoma and non-small cell lung cancer. Cutis 2020; 105 (6): E9-E12.
5. Lopez AT, Khanna T, Antonov N, Audrey-Bayan C, Geskin L. A review of bullous pemphigoid associated with PD-1 and PD-L1 inhibitors. Int J Dermatol 2018; 57 (6): 664-669. doi: 10.1111/ijd.13984.
6. Kwon CW, Land AS, Smoller BR, Scott G, Beck LA, Mercurio MG. Bullous pemphigoid associated with nivolumab, a programmed cell death 1 protein inhibitor. J Eur Acad Dermatol Venereol 2017; 31 (8): e349-e350. doi: 10.1111/jdv.14143.
7. Wesolow JT, Jalali S, Clark LD. A rare case of bullous pemphigoid secondary to checkpoint inhibitor immunotherapy: A tense situation. Cureus 2021; 13 (7): e16169. doi: 10.7759/cureus.16169.
8. Gotera N, Weilg P, Heleno C, Ferrari-Gabilondo N. A case of bullous pemphigoid associated with nivolumab therapy. Cureus 2022; 14 (5): e24804. doi: 10.7759/cureus.24804.
9. Muntyanu A, Netchiporouk E, Gerstein W, Gniadecki R, Litvinov IV. Cutaneous immune-related adverse events (irAEs) to immune checkpoint inhibitors: A dermatology perspective on management. J Cutan Med Surg 2021; 25 (1): 59-76. doi: 10.1177/1203475420943260.
10. Ellis SR, Vierra AT, Millsop JW, Lacouture ME, Kiuru M. Dermatologic toxicities to immune checkpoint inhibitor therapy: A review of histopathologic features. J Am Acad Dermatol 2020; 83 (4): 1130-1143. doi:10.1016/j.jaad.2020.04.105.
11. Wu X, Palvai S, Jalil A. Nivolumab-induced severe bullous pemphigoid in a patient with renal cancer: a case report and literature review. J Cancer Metastasis Treat 2020; 6: 40. doi:10.20517/2394-4722.2020.77.
12. Darnell EP, Mooradian MJ, Baruch EN, Yilmaz M, Reynolds KL. Immune-related adverse events (irAEs): Diagnosis, management, and clinical pearls. Curr Oncol Rep 2020; 22 (4): 39. doi: 10.1007/s11912-020-0897-9.
13. Kosche C, Owen JL, Sadowsky LM, Choi JN. Bullous dermatoses secondary to anti-PD-L1 agents: a case report and review of the literature. Dermatol Online J 2019; 25 (10): 13030/qt7qg9675d.
14. Quach HT, Johnson DB, LeBoeuf NR, Zwerner JP, Dewan AK. Cutaneous adverse events caused by immune checkpoint inhibitors. J Am Acad Dermatol 2021; 85 (4): 956-966. doi: 10.1016/j.jaad.2020.09.054.
Recibido: agosto 2023
Aceptado: septiembre 2023
Este artículo debe citarse como: Rojas-López RF, López-Molinares LI, Reyes-Rivero EL. Penfigoide ampolloso asociado con nivolumab: reto diagnóstico en un paciente con melanoma. Dermatol Rev Mex 2023; 67 (3): 456-459.

