Onychopathy secondary to capecitabine and taxane.
Dermatol Rev Mex. 2021; 65 (3): 440-443. https://doi.org/10.24245/dermatolrevmex.v65i3.5789
Marcela A Rimoldi,1 Marco Di Corpo,2 María Laura Gubiani,3 María Pía Boldrini,3 Beatriz Al Pinardi4
1 Residente del servicio de Dermatología.
2 Médico de planta, especialidad de Cirugía general.
3 Médica de planta, especialidad de Dermatología.
4 Jefa de División del servicio de Dermatología.
Nuevo Hospital San Roque, Córdoba, Argentina.
Sr. Editor:
Quiero comentarle que existe evidencia de que varios agentes quimioterapéuticos, incluidos los taxoides, ciclofosfamida, doxorrubicina, 5-fluorouracilo, vincristina o combinaciones de éstos pueden inducir cambios ungueales y periungueales. Las alteraciones pueden involucrar la matriz ungueal, el lecho ungueal, el pliegue ungueal proximal o los tres. La mayor parte de estos eventos adversos son de gravedad leve a moderada, pero si no se manejan adecuadamente, pueden provocar dolor significativo e interferir con las actividades de la vida diaria.1
A continuación comunicamos el caso de un paciente con afectación ungueal secundaria a la toma de capecitabina y docetaxel junto a una revisión bibliográfica.
CASO CLÍNICO
Paciente masculino de 58 años de edad con antecedentes personales patológicos de adenocarcinoma de esófago por lo que se le realizó esofaguectomía total trashiatal y se administraron 6 ciclos de quimioterapia con docetaxel (80 mg días 1 y 15), oxaliplatino (130 mg días 1 y 5) y capecitabina 2250 mg; acudió a la consulta por padecer lesiones ungueales asintomáticas de cinco meses de evolución.
El paciente refería que las alteraciones ungueales comenzaron a manifestarse luego del quinto ciclo de quimioterapia, por lo que la capecitabina fue suspendida por el servicio de Oncología y se continuó con los otros dos fármacos. Al permanecer con lesiones ungueales fue medicado por su médico tratante con fluconazol 200 mg (dos cápsulas semanales) y cefalexina 500 mg (6 cápsulas al día durante cinco días).
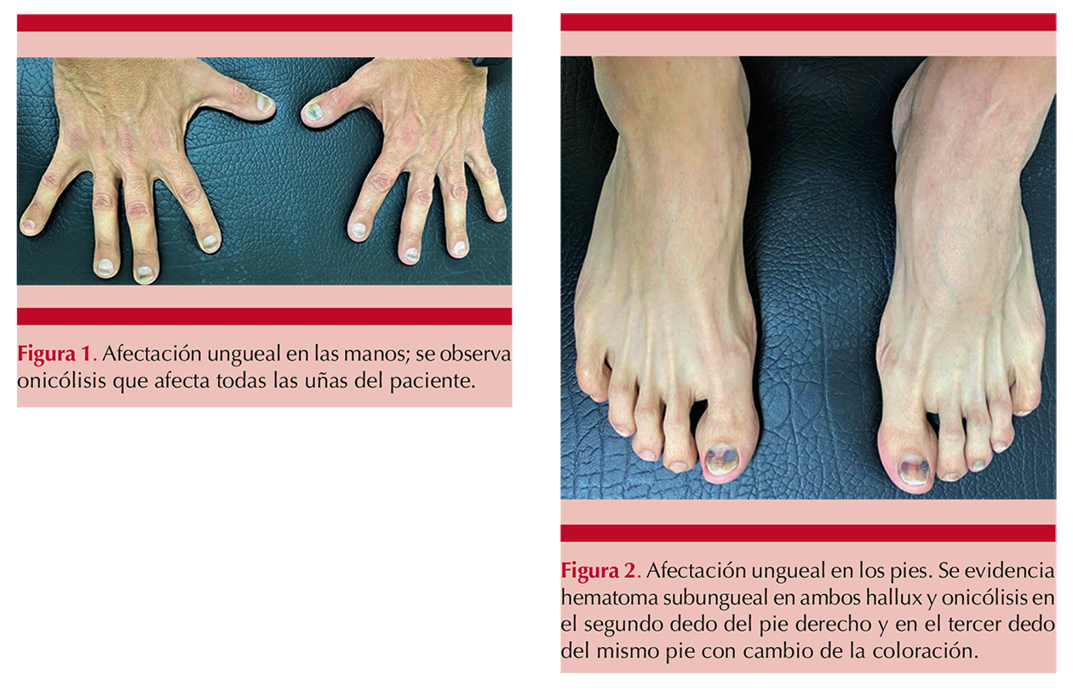
Al examen físico se observó en las manos, onicólisis que afectaba todas las uñas (Figura 1) y en el pie se observó un hematoma subungueal en ambos hallux y onicólisis en el pie izquierdo. Figura 2
Se suspendió el fluconazol y posteriormente se solicitó examen directo y cultivo para estudio micológico, que se informó como negativo.
DISCUSIÓN
Entre los agentes quimioterapéuticos, los taxanos (paclitaxel o docetaxel) se han prescrito como agentes únicos o como terapia combinada. Los taxanos actúan como agentes antimicrotúbulos al promover la polimerización de la tubulina en microtúbulos intracelulares altamente estables, lo que altera la mitosis y la división celular normal y finalmente conduce a la muerte celular.5 Cuando se combina con capecitabina los taxanos aumentan la actividad de la timidina fosforilasa que es una enzima esencial para la activación de capecitabina.1-8 La capecitabina es un carbamato de fluoropirimidina con actividad antineoplásica, un profármaco sistémico administrado por vía oral de 5’-desoxi-5-fluorouridina que se convierte en 5-fluorouracilo y se activa preferentemente en el sitio del tumor.3 Ambos medicamentos han demostrado ser efectivos en el tratamiento de una gran variedad de tumores sólidos,2-5 entre ellos, el cáncer de esófago8-10 ya que esta asociación mejora la calidad de vida en comparación con la combinación con otros medicamentos.9
Las anormalidades en las uñas son un efecto secundario común de la quimioterapia sistémica.6 La afectación ungueal se debe a los mecanismos de toxicidad directa y al cese de la actividad mitótica de la matriz ungueal.2,3,4 La gravedad de la onicopatía puede depender de la duración y la dosis acumulada de los agentes quimioterapéuticos, así como del componente ungueal afectado.7
En 2006 el Instituto Nacional de Cáncer de Argentina clasificó los efectos adversos y el grado de toxicidad ungueales de la quimioterapia (Cuadro 1). Las lesiones de nuestro paciente corresponden al grado II.11

Los cambios ungueales inducidos por los taxanos se asocian con alta incidencia, que alcanza hasta el 44%.4
En contrapartida, la prevalencia de las afecciones ungueales asociadas con la capecitabina se subestima debido a los pocos informes de toxicidad como monoterapia.2-10 Ambos fármacos comparten las mismas afecciones que se detallan en el Cuadro 2.2-7,12

La aparición de hemorragias en astilla y hematomas subungueales podría explicarse por la trombocitopenia y las anormalidades vasculares inducidas por los citostáticos.4
Nuestro paciente tenía hemorragia subungueal y onicólisis.
Además de la afectación ungueal, los taxoides también pueden producir efectos adversos cutáneos, como: xerosis, urticaria, prurito, exantema maculopapular, alopecia, síndrome dorsal mano-pie, síndrome palmoplantar mano-pie, erupciones pustulares, cambios pigmentarios, eritema fijo medicamentoso, lupus eritematoso inducido por fármacos, cambios similares a la esclerodermia y mucositis.5,6,7 En cuanto a la capecitabina, el síndrome mano-pie ocurre en un 50-68% de los pacientes tratados con ese fármaco. Otros efectos secundarios menos frecuentes son: hiperpigmentaciones cutáneas localizadas o generalizadas, cambios esclerodermiformes acrales, queratodermias palmoplantares adquiridas y mucositis.2,10,12
Los tratamientos implicados son de contención porque las manifestaciones son dependientes de las dosis, por lo que a veces se requieren interrupciones transitorias, reducción de la dosis o incluso la suspensión de la quimioterapia.5,6 Además, debe tenerse en cuenta que la toxicidad puede provocar desprendimiento de la lámina ungueal, con riesgo de sobreinfección bacteriana durante el periodo de neutropenia secundario a la quimioterapia.7
CONCLUSIONES
En la actualidad existe mayor comunicación de casos que describen los efectos secundarios en la piel y los anexos de los fármacos antineoplásicos. La constante aparición de nuevos medicamentos obliga a conocer estas manifestaciones para no establecer diagnósticos erróneos ni tratamientos innecesarios, como en el caso comunicado.
REFERENCIAS
1. Sawada N, Ishikawa T, Fukase Y, Nishida M, et al. Induction of thymidine phosphorylase activity and enhancement of capecitabine efficacy by taxol/taxotere in human cancer xenografts. Clin Cancer Res 1998; 4: 1013-9.
2. Vaccaro M, Barbuzza O, Guarneri F, Guarneri B. Nail and periungual toxicity following capecitabine therapy. Br J Pharmacol 2008; 66 (2): 325-326. doi. 10.1111/j.1365-2125.2008.03174.x.
3. Stathopoulos GP, Koutantos J, Lazaki H, Rigatos SK, et al. Capecitabine (Xeloda) as monotherapy in advanced breast and colorectal cancer: effectiveness and side-effects. Anticancer Res 2007; 27: 1653-166.
4. Minisini AM, Tosti A, Sobrero AF, Manusutti M, et al. Taxane induced nail changes: incidence, clinical presentation and outcome. Ann Oncol 2003; 14: 333-337.
5. Sibaud V, Lebœuf N, Roche H, Belum V, et al. Dermatological adverse events with taxane chemotherapy. Eur J Dermatol 2016; 26 (5): 427-443. doi. 10.1684/ejd.2016.2833.
6. Saraswat N, Sood A, Verma R, Kumar D, et al. Nail changes induced by chemotherapeutic agents . Indian J Dermatol 2020; 65 (3): 193-198.
7. Piraccini BM, Alessandrini A. Drug-related nail disease. Clin Dermatol 2013; 31 (5): 618-26. doi. 10.1016/j.clindermatol.2013.06.013.
8. Lee SJ, Kim S, Kim M, Lee J, et al. Capecitabine in combination with either cisplatin or weekly paclitaxel as a first-line treatment for metastatic esophageal squamous cell carcinoma: a randomized phase II study. BMC Cancer 2015; 15: 693.
9. Korkeila EA, Salminen T, Kallio R, et al. Calidad de vida con docetaxel y capecitabina quincenales en el cáncer gastroesofágico avanzado. Apoyo a la atención del cáncer 2017; 25 (9): 2771-2777.
10. Walko C, Lindley C. Capecitabina: una revisión. Terapéutica clínica 2005; 27 (1): 23-44.
11. http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf, p. 16, consultado el 17 de julio de 2020.
12. Chang P, Borjas-Leiva CA. Onicopatía por capecitabina. Dermatología CMQ 2009; 7 (2): 141-144.
Recibido: diciembre 2020
Aceptado: febrero 2021
Este artículo debe citarse como: Rimoldi MA, Di Corpo M, Gubiani ML, Boldrini MP, Pinardi B. Onicopatía secundaria a capecitabina y taxanos. Dermatol Rev Mex 2021; 65 (3): 440-443.