Dermatol Rev Mex. 2025; 69 (5): 750-756. https://doi.org/10.24245/dermatolrevmex.v69i5.10753
María Verónica Gómez Bisogno,1 Fernando Gómez Daza,2 Dilia K Martínez Méndez3
1 Médico cirujano, Ambulatorio 810. Valencia, Venezuela.
2 Licenciado en Bioanálisis. Micólogo médico. Laboratorio de Micología y Enfermedades Tropicales, Valencia, Venezuela.
3 Médico micólogo, Unidad de Inmunología, Neurodesarrollo y Metabolismo, Venezuela.
Estimados editores:
La histoplasmosis diseminada-extrapulmonar puede sobrevenir por reactivación de focos latentes o primoinfección en pacientes inmunodeprimidos en quienes las manifestaciones cutáneas ocurren entre el 11 y el 21%.1 Histoplasma spp está en la lista de patógenos fúngicos prioritarios de la Organización Mundial de la Salud (OMS), reconociendo la importancia para la salud pública, la carga económica mundial y poca inversión en investigación que acrecienta el desconocimiento existente.2
La técnica de la escarificación ha demostrado ofrecer ventajas sobre las muestras invasivas (aspirados, biopsias, hemocultivos) para la obtención de material suficiente, incluso para ensayos moleculares, con disminución de infecciones iatrogénicas.3,4 Utilizada en el diagnóstico de leishmaniasis cutánea, es un método poco invasivo, rápido y sencillo de practicar, que conserva mejor la morfología del parásito, cuya sensibilidad aumenta al incrementar la cantidad de muestras y llega al 88% de positividad contra el 59% de la histología, aunque depende de la experticia del observador. Se recomienda para confirmar el diagnóstico en pacientes con biopsia negativa, pero criterio clínico-epidemiológico para la enfermedad.5
Frotis por escarificado: técnica y utilidad
La técnica se ejecuta previa asepsia y antisepsia, con ayuda de una pinza curva se realiza restricción de la circulación sanguínea hasta quedar pálida y se obtiene la muestra por escarificación de la superficie de la lesión utilizando un bisturí 15 estéril (Figura 1A-C). La compresión de la lesión lleva a isquemia y a aumento de la linfa dérmica, lo que puede mejorar el rendimiento de la prueba. Con el material obtenido en el bisturí se hace extendido sobre lámina portaobjeto que se tiñe con Giemsa (Figura 1D), y se busca observar dentro o fuera de macrófagos las levaduras de Histoplasma spp (Figura 1E-I), lo que permite establecer el diagnóstico de histoplasmosis diseminada en, aproximadamente, 30 minutos, favoreciendo el inicio del tratamiento.
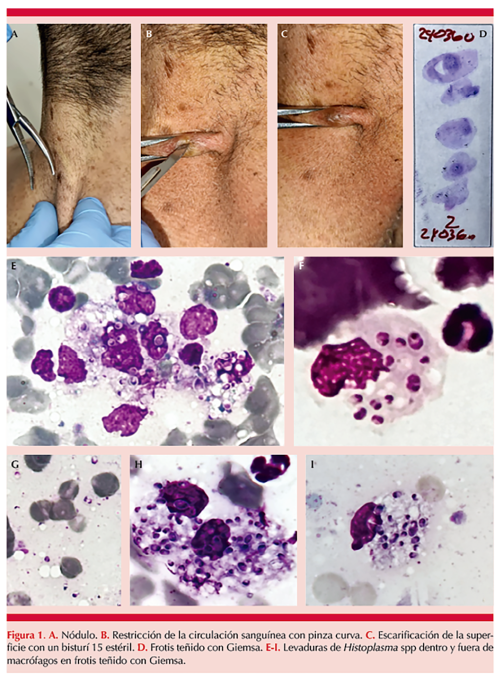
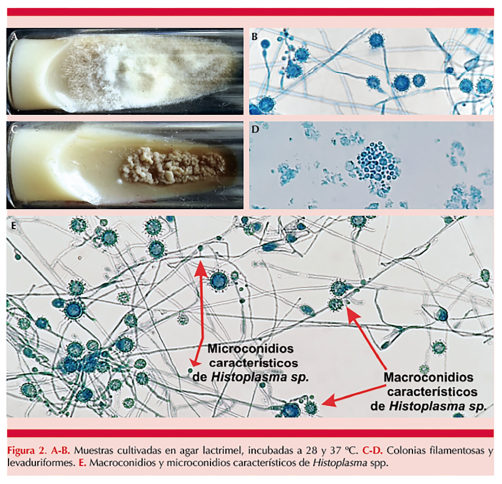
La muestra obtenida con la hoja de bisturí también se coloca sobre medios de cultivo para hongos: agar Sabouraud, papa dextrosa, lactrimel, Mycosel® y cerebro-corazón y se incuba a 28 y 37 ºC para el aislamiento del patógeno observándolos cada cinco días hasta visualizar el crecimiento de colonias levaduriformes y filamentosas (que confirman en el dimorfismo térmico), cuyas características fenotípicas macroscópicas y microscópicas (macro y microconidios) correspondan con Histoplasma spp (Figura 2), lo que confirma el diagnóstico micológico.
El diagnóstico puede complementarse con serología por inmunodifusión doble, en donde podrá detectarse la banda h, m (o ambas) de identidad antigénica contra un control positivo (comercial o casero estandarizado). La banda h aparecerá más cerca del orificio de anticuerpo, mientras que la banda m estará más cerca del orificio del antígeno. La banda h aparece en infección temprana, la banda h y m simultáneas indican enfermedad activa y la banda m enfermedad activa o fase de convalecencia. El resultado definitivo se envía al médico tratante para la actualización del diagnóstico definitivo y tratamiento específico.
Las fotografías se utilizaron con el consentimiento informado de los pacientes.
DISCUSIÓN
La histoplasmosis tiene distribución cosmopolita; se han descrito casos en más de 60 países, probablemente influenciado por las migraciones humanas, el cambio en los ecosistemas y la pandemia del SIDA. En América existen zonas altamente endémicas en Estados Unidos, Panamá, Venezuela, Brasil, Colombia y Argentina.1,6 En Venezuela la identificó Humberto Campins en 1949 y desde esa fecha se ha reportado en los estados con mayor densidad poblacional que reúnen las condiciones ecológicas para el crecimiento del hongo y es la más reportada en pacientes con VIH-SIDA.6,7
Las manifestaciones cutáneas, por lo general, son comunes en la histoplasmosis diseminada-extrapulmonar en pacientes con VIH-SIDA con bajas concentraciones de CD4 y alta viremia, y pueden semejar leishmaniasis, talaromicosis, emergomicosis, escrofuloderma y sífilis, entre otras enfermedades infecciosas.1 Las lesiones dermatológicas son polimorfas; pueden ir desde una mácula, pápula, placa, nódulo hasta úlceras necróticas en la piel y las mucosas (Figura 3). Se dividen en lesiones causadas por la existencia del hongo en la piel y las ocasionadas por la reacción cutánea atribuibles a la infección micótica sistémica.8,9
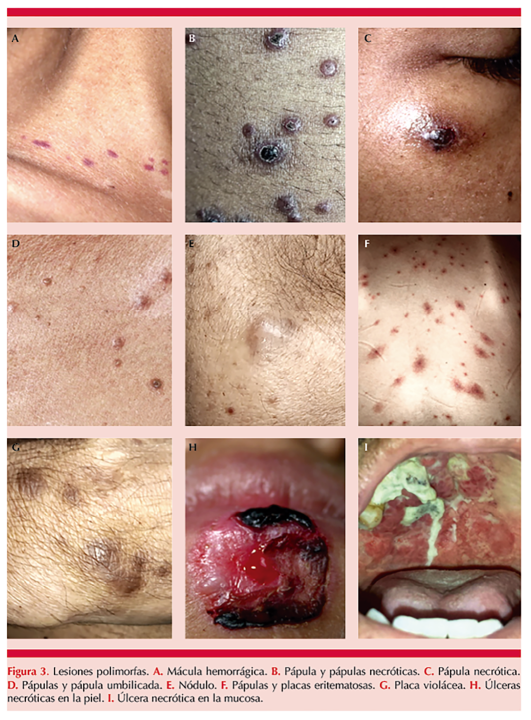
De forma extremadamente rara (0.5%) se han reportado casos de histoplasmosis cutánea primaria (hcp), que afecta a individuos con ocupaciones en las que pueden manipular el agente etiológico: mineros, agricultores, arqueólogos, recolectores de guano, geólogos, personal de laboratorio y obreros de la construcción. La lesión inicial es inespecífica y de alivio espontáneo, por lo que suele pasar inadvertida en un individuo inmunocompetente.10
El diagnóstico temprano es fundamental y el método más sencillo, rápido, barato y poco invasivo es la colección de muestras de varias lesiones por escarificado con hoja de bisturí 15, previa restricción de la circulación sanguínea con ayuda de una pinza curva. El material obtenido se extiende en una lámina portaobjeto para teñirlo con el colorante de Giemsa y sembrarlo en medios de cultivo para hongos. El frotis permite observar rápidamente la levadura de Histoplasma sp dentro o fuera de macrófagos, e iniciar de manera temprana el tratamiento específico, a diferencia de otros métodos diagnósticos, como la histopatología, cuyo resultado no es perentorio.
El cultivo es el método confirmatorio, pero tardío: hay que dejar incubando los medios, incluso, 45 días a temperatura ambiente (28 ºC) y a 37 ºC para evidenciar el dimorfismo, aunque en ocasiones puede identificarse al hongo antes de 20 días.
En 2017 Sepúlveda y colaboradores, con la secuenciación de todo el genoma, propusieron una nueva clasificación taxonómica del género Histoplasma, divididieron a Histoplasma capsulatum var. capsulatum en cuatro especies crípticas: H capsulatum sensu stricto (conocida como linaje Panamá o H81), distribuida en Panamá; Histoplasma mississippiense (linaje NAm1), Histoplasma ohiense (linaje NAm2) e Histoplasma suramericanum (linaje LAmA), que circula en Sudamérica, en particular en Venezuela, con una variedad Histoplasma capsulatum var. duboisii que se encuentra en África.1,6,9 La identificación definitiva de las especies se hace por técnicas de biología molecular, espectrometría de masas (MALDI-TOF) o ambas.11
La sensibilidad del diagnóstico serológico puede variar entre el 38 y el 81% (es especialmente baja en individuos inmunodeprimidos).1,12 La reclasificación de géneros y especies plantea la interrogante de la significación clínica y la respuesta inmunitaria a los métodos diagnósticos y la respuesta a los fármacos.1,6 Los estudios genómicos prueban que los aislamientos de hongos productores de micosis sistémicas en Venezuela son Histoplasma suramericanum, Paracoccidioides venezuelensis y Coccidioides posadasii y, en la actualidad, se evalúa la respuesta serológica al uso de antígenos comerciales y específicos de especie en el diagnóstico serológico.6
Además de personal experimentado con formación en micología, debe sumarse la necesidad de pruebas diagnósticas especie-específicas, dotación de herramientas de biología molecular e infraestructura de bioseguridad,1 por lo que la identificación del agente causal con métodos clásicos sigue representando una excelente alternativa diagnóstica que permite el tratamiento específico, mientras se completa la identificación genética. Para el diagnóstico de la histoplasmosis cutánea, la técnica por escarificado de las lesiones es un método sencillo, rápido, barato y poco invasivo que puede hacerse, incluso, a pie de cama del paciente, que ha demostrado buen rendimiento diagnóstico en pacientes inmunodeprimidos.4,5
CONCLUSIONES
Las micosis son cada vez más cosmopolitas. La movilidad poblacional (turismo, trabajo, negocios), la dinámica migratoria (migraciones, refugiados), las características del esparcimiento, las relaciones humanas y la creciente cifra de personas inmunosuprimidas amerita, y de inmediato, la integración del diagnóstico eficaz y oportuno con las técnicas diagnósticas actualizadas y adaptadas a la realidad de cada centro, el desarrollo de fármacos eficaces, con menos efectos adversos y accesibles, así como la formación de más profesionales especializados en las micosis, sus agentes causales y los métodos diagnósticos.
REFERENCIAS
1. Carrasco-Zuber J, Navarrete-Dechent C, Bonifaz A, et al. D. Afectación cutánea en las micosis profundas: una revisión de la literatura. Parte 2. Micosis sistémicas. Actas Dermo-Sifiliogr 2016; 107: 816-22.
2. Organización Mundial de la Salud (OMS). Lista de patógenos fúngicos prioritários. Octubre, 2022. https://www.who.int/publications/i/item/9789240060241
3. De Los Santos MB, Loyola S, Perez-Velez ES, et al. Sampling is decisive to determination of Leishmania (Viannia) species. PLoS Negl Trop Dis 2024; 18 (4): e0012113. https://doi.org.10.1371/journal.pntd.001211
4. Santosh T, Kothari K, Singhal SS, et al. Disseminated histoplasmosis in an immunocompetent patient – utility of skin scrape cytology in diagnosis: a case report. J Med Case Rep 2018; 12 (1): 7. https://doi.org.10.1186/s13256-017-1543-5
5. Pascual-González Y. Diagnóstico de leishmaniosis cutánea mediante frotis por escarificación con biopsia negativa de la lesión. Med Cutan Iber Lat Am 2012; 40 (6): 197-199. https://doi.org.10.4464/MD.2012.40.6.5044
6. Alvarado P, Vivas J. Diversidad genómica de hongos productores de micosis profundas en Venezuela. Tribuna del Investigador 2020; 21 (2): 43-51.
7. Martínez-Méndez D, Hernández R, Alvarado P, y col. Las micosis en Venezuela: casuística de los Grupos de Trabajo en Micología (1984-2010). Rev Iberoam Micol 2013; 30 (1): 39-46. http://dx.doi.org/10.1016/j.riam.2012.10.00
8. Cáceres DH, Gómez BL, Tobón ÁM, et al. Tackling histoplasmosis infection in people living with HIV from Latin America: From diagnostic strategy to public health solutions. J Fungi (Basel) 2023; 9 (5): 558. https://doi.org.10.3390/jof9050558
9. Cubas WS, Jiménez G, Vega J. Lesiones cutáneas como manifestación de una histoplasmosis diseminada en un hospital del Perú. Rev Chil Infectol 2017; 34 (6): 613-614. http://dx.doi.org/10.4067/S0716-10182017000600613
10. Castos LP, Gomez C, Uhia C, et al. Histoplasmosis cutánea primaria. Reporte de caso. Dermatol CMQ 2020; 18 (4).
11. Sepúlveda VE, Márquez R, Turissini DA, et al. Genome sequences reveal cryptic speciation in the human pathogen Histoplasma capsulatum. 2017; mBio 8 (6): e01339-17. https://doi.org/10.1128/mbio.01339-17
12. López Daneri AG, Arechavala A, Iovannitti CA, et al. Histoplasmosis diseminada en pacientes HIV/Sida. Buenos Aires, 2009-2014. Medicina (B Aires) 2016; 76 (6): 332-337.
ORCID
https://orcid.org/0000-0003-2677-2589
https://orcid.org/0000-0003-2989-2949
Recibido: julio 2025
Aceptado: julio 2025
Este artículo debe citarse como: Gómez-Bisogno MV, Gómez-Daza F, Martínez-Méndez DK. El frotis por escarificado: utilidad en el diagnóstico de histoplasmosis diseminada. Dermatol Rev Mex 2025; 69 (5): 750-756.